Chemie berylia netypická pro skupinu 2
Když berylium tvoří ion 2+, ztrácí 2 elektrony v orbitalu 2s. Tím zůstane 2-úroveň zcela prázdná.
Orbitaly 2-úrovně se reorganizují (hybridizují) a vytvářejí čtyři stejné orbitaly, z nichž každý může přijmout osamělý pár elektronů z molekuly vody. V dalším diagramu byly vynechány elektrony 1s. Pro vazbu nejsou důležité.
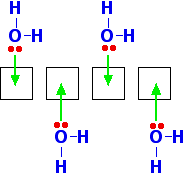
Každá molekula vody má samozřejmě dva osamělé páry elektronů. Aby nedošlo k znepřehlednění diagramu, je zobrazen pouze jeden z nich.
Všimněte si, že jakmile se tímto způsobem naváží čtyři molekuly vody, na vazebné úrovni už není k dispozici žádné místo. Využívají se všechny prázdné orbitaly z původního iontu berylia.
Molekuly vody se uspořádají tak, aby se dostaly co nejdále od sebe – což směřuje k rohům čtyřstěnu. Iont má tedy tetraedrický tvar.
Hydratace hořčíku
Mohli byste si myslet, že hořčík se bude chovat stejně, ale na 3. úrovni jsou k dispozici 3d orbitaly a také 3s a 3p.
Při vzniku hořečnatého iontu zůstávají prázdné 3s, 3p a 3d orbitaly. Když je tento ion hydratován, využívá orbital 3s, všechny tři orbitaly 3p a dva orbitaly 3d. Ty se přeorganizují a ponechají celkem šest prázdných orbitalů, které se pak používají pro vazbu.
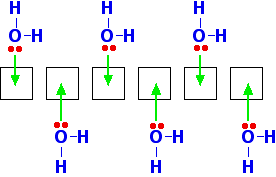
Proč se hořčík zastaví na připojení šesti vod? Proč nevyužívá i zbývající 3d orbitaly? Kolem hořčíku se fyzicky nevejde více než šest molekul vody – zabírají příliš mnoho místa.
Co ostatní ionty ve skupině 2?
Jak se ionty zvětšují, mají menší tendenci vytvářet s molekulami vody správné koordinační vazby. Ionty jsou tak velké, že nejsou dostatečně přitažlivé pro osamělé páry na molekulách vody, aby vytvořily formální vazby – místo toho mají molekuly vody tendenci shlukovat se volněji kolem kladných iontů.
Pokud však vytvoří koordinační vazby s vodou, budou 6-koordinované stejně jako hořčík.
Hydroxid berylia je amfoterní
Amfoterní znamená, že může reagovat s kyselinami i zásadami za vzniku solí.
Ostatní hydroxidy skupiny 2
Všechny ostatní hydroxidy kovů skupiny 2 jsou zásadité. Reagují s kyselinami za vzniku solí. Například:
![]()
Hydroxid vápenatý reaguje se zředěnou kyselinou chlorovodíkovou za vzniku chloridu vápenatého a vody.
Hydroxid berylia
Hydroxid berylia reaguje s kyselinami za vzniku roztoků solí berylia. Například:
![]()
Reaguje však také se zásadami, například s roztokem hydroxidu sodného. Hydroxid berylnatý reaguje s hydroxidem sodným za vzniku bezbarvého roztoku tetrahydroxoberylátu sodného.
![]()
Ten obsahuje komplexní ion, 2-. Název vystihuje tento iont. Tetra znamená čtyři; hydroxo odkazuje na OH skupiny; berylát ukazuje, že beryllium je přítomno v záporném iontu. Koncovka „ate“ vždy ukazuje, že iont je záporný.
Podívejme se na to jako na jednoduché schéma toku, počínaje ionty berylia v roztoku:
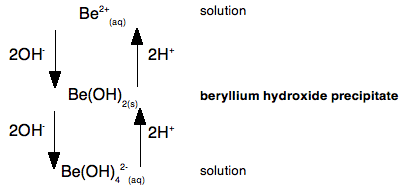
To ukazuje, že pokud k iontům berylia v roztoku přidáme hydroxidové ionty, dostaneme nejprve sraženinu hydroxidu berylia. Pokud však přidáte další hydroxidové ionty, sraženina se opět rozpustí a vznikne roztok obsahující tetrahydroxoberylátové ionty.
Hydroxid berylnatý reaguje se zásadou (hydroxidovými ionty), a proto musí mít kyselé vlastnosti.
Přidáte-li však k tetrahydroxoberylátovým iontům kyselinu, dostanete opět sraženinu hydroxidu berylnatého. A pokud přidáte ještě více kyseliny, vrátíte se k původním iontům berylia v roztoku.
Protože hydroxid berylia reaguje s kyselinou, musí mít kromě kyselých vlastností i vlastnosti zásadité – je amfoterní.
Jednoduché vysvětlení toho, co se děje
Na to se musíme podívat znovu, ale uvažovat o iontu berylia v roztoku podrobněji – jinými slovy jako Be(H2O)42+.
Velmi malý kladně nabitý iont berylia ve středu komplexu k sobě přitahuje elektrony v molekulách vody – říkáme, že má silný polarizační účinek na molekuly vody.
Berylium má tak silný polarizační účinek na molekuly vody, že se z nich velmi snadno odstraňují vodíkové ionty.
Roztok hydroxidu sodného obsahuje hydroxidové ionty, které jsou silnými zásadami. Pokud přidáte správné množství roztoku hydroxidu sodného, získáte sraženinu, která se obvykle nazývá „hydroxid berylnatý“ – ale která je strukturně poněkud složitější!“
![]()
Produkt (kromě vody) je neutrální komplex a je kovalentně vázaný. Jediné, co se stalo s původním komplexním iontem, je, že z molekul vody byly odstraněny dva vodíkové ionty.
Díky tomu, že na něm chybí náboj, získáte srážku neutrálního komplexu. Mezi tímto neutrálním komplexem a molekulami vody není dostatečná přitažlivost, aby se dostal do roztoku.
Co se stane, když přidáte další hydroxidové ionty?
Přidáním dalších hydroxidových iontů k neutrálnímu komplexu se z molekul vody odtrhne více vodíkových iontů a vznikne tetrahydroxoberylátový ion:
![]()
Hydroxid berylu se rozpustí, protože neutrální komplex se přemění na ion, který bude dostatečně přitahován molekulami vody.
Co se stane, když ke sraženině hydroxidu berylnatého (neutrálnímu komplexu) přidáte kyselinu?
Původně odstraněné vodíkové ionty se jednoduše nahradí. Sraženina se rozpustí, protože se znovu vytvoří původní hydratovaný iont berylia.
![]()
Podívejme se na to znovu jako na průběhové schéma, abyste ho mohli porovnat s výše uvedeným:
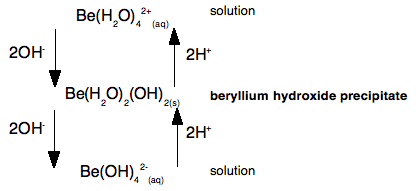
Hydroxid berylia (neutrální komplex) je amfoterní, protože může reagovat se zásadou i kyselinou. V každém případě se děje pouze to, že buď odebíráte vodíkové ionty z molekul vody, nebo je nahrazujete.
Proč se tak neděje například u hydroxidu vápenatého?
Hydroxid vápenatý je skutečně iontový – a obsahuje jednoduché hydroxidové ionty, OH-. Ty reagují s vodíkovými ionty kyseliny za vzniku vody – a tak hydroxid reaguje s kyselinami.
Neexistuje však žádný ekvivalent neutrálního komplexu. Přidání dalších hydroxidových iontů ze zásady nemá žádný účinek, protože nemají s čím reagovat.