Alfenta
Genetischer Name: Alfentanil-Hydrochlorid
Dosierungsform: Injektion
Medizinisch geprüft von Drugs.com. Zuletzt aktualisiert am 22. Jan. 2021.
- Nebenwirkungen
- Dosierung
- Beratung
- Interaktionen
- Schwangerschaft
- Mehr
CII
Nur Rx
- Alfenta Beschreibung
- Alfenta – Klinische Pharmakologie
- Indikationen und Anwendung von Alfenta
- Kontraindikationen
- Warnhinweise
- Vorsichtsmaßnahmen
- Allgemein
- Kopfverletzungen
- Beeinträchtigte Atmung
- Eingeschränkte Leber- oder Nierenfunktion
- Wechselwirkungen mit Arzneimitteln
- Karzinogenese, Mutagenese und Beeinträchtigung der Fruchtbarkeit
- Schwangerschaftskategorie C
- Labor und Entbindung
- Stillende Mütter
- Anwendung bei Kindern
- Nebenwirkungen
- Inzidenz größer als 1 % – wahrscheinlich ursächlich (abgeleitet aus klinischen Studien)
- Inzidenz weniger als 1 % – wahrscheinlich ursächlich (abgeleitet aus klinischen Studien)
- Drogenmissbrauch und -abhängigkeit
- Überdosierung
- Alfenta Dosierung und Verabreichung
- Anwendung bei Kindern
- Prämedikation
- Neuromuskuläre Blocker
- SICHERHEIT UND HANDHABUNG
- Wie wird Alfenta geliefert
Alfenta Beschreibung
Alfenta (Alfentanilhydrochlorid) Injektion ist ein Opioid-Analgetikum, chemisch bezeichnet als N–4-(Methoxymethyl)-4-piperidinyl]-N-phenylpropanamid-Monohydrochlorid (1:1) mit einem Molekulargewicht von 452.98 und einem n-Octanol:Wasser-Verteilungskoeffizienten von 128:1 bei pH 7,4. Die Strukturformel von Alfenta lautet:
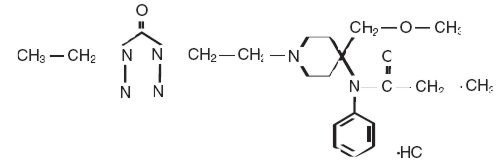
Alfenta ist eine sterile, nicht-pyrogene, konservierungsmittelfreie wässrige Lösung, die Alfentanilhydrochlorid enthält, das 500 µg pro ml Alfentanil-Base zur intravenösen Injektion entspricht. Die Lösung, die zur Isotonisierung Natriumchlorid enthält, hat einen pH-Bereich von 4-6. Jeder mL enthält: Aktiv: Alfentanil-Base 500 mcg. Inaktiv: Natriumchlorid 9 mg und Wasser für Injektionszwecke Q.S.
Alfenta – Klinische Pharmakologie
Alfenta (Alfentanilhydrochlorid) ist ein opioides Analgetikum mit schnellem Wirkungseintritt.
Bei chirurgischen Eingriffen mit einer Dauer von bis zu 30 Minuten bietet Alfenta in einer Dosierung von 8-40 mcg/kg einen analgetischen Schutz vor hämodynamischen Reaktionen auf chirurgische Belastungen, wobei die Erholungszeiten im Allgemeinen mit denen vergleichbar sind, die bei äquivalenten Fentanyl-Dosierungen beobachtet werden.
Bei längeren Eingriffen dämpfen Dosen von bis zu 75 mcg/kg die hämodynamischen Reaktionen auf Laryngoskopie, Intubation und Inzision, wobei die Erholungszeiten mit denen von Fentanyl vergleichbar sind. Bei Dosen von 50-75 mcg/kg, gefolgt von einer kontinuierlichen Infusion von 0,5-3 mcg/kg/min, dämpft Alfenta die Katecholaminreaktion mit einer schnelleren Erholung und einem geringeren Bedarf an postoperativen Analgetika im Vergleich zu Patienten, denen Enfluran verabreicht wurde. Bei einer Dosis von 5 mcg/kg bietet Alfenta eine Analgesie für den bewussten, aber sedierten Patienten. Je nach Ansprechen des Patienten können auch höhere Dosen als 5 mcg/kg erforderlich sein. Ältere oder geschwächte Patienten benötigen möglicherweise niedrigere Dosen. Die Pharmakokinetik von Alfenta kann als Drei-Kompartiment-Modell beschrieben werden, mit sequenziellen Verteilungshalbwertszeiten von 1 und 14 Minuten und einer terminalen Eliminationshalbwertszeit von 90-111 Minuten (im Vergleich zu einer terminalen Eliminationshalbwertszeit von etwa 475 Minuten für Fentanyl und etwa 265 Minuten für Sufentanil bei Dosen von 250 mcg). Die Leber ist der Hauptort der Biotransformation.
Alfenta hat ein scheinbares Verteilungsvolumen von 0,4-1 L/kg, was etwa ein Viertel bis ein Zehntel des Verteilungsvolumens von Fentanyl ist, mit einer durchschnittlichen Plasma-Clearance von 5 ml/kg/Min. im Vergleich zu etwa 8 ml/kg/Min. für Fentanyl.
Nur 1,0 % der Dosis wird als unverändertes Arzneimittel ausgeschieden; die Ausscheidung über den Urin ist der Hauptausscheidungsweg der Metaboliten. Die Plasmaproteinbindung von Alfenta beträgt etwa 92 %.
In einer Studie mit 15 Patienten, denen Alfenta zusammen mit Lachgas/Sauerstoff verabreicht wurde, zeigte sich, dass ein enger Bereich von Alfenta-Plasmakonzentrationen, etwa 310-340 ng/ml, eine angemessene Anästhesie für intraabdominale Eingriffe ermöglichte, während niedrigere Konzentrationen, etwa 190 ng/ml, die Reaktionen auf den Hautverschluss blockierten. Plasmakonzentrationen zwischen 100-200 ng/ml sorgten für eine angemessene Anästhesie bei oberflächlichen Eingriffen.
Alfenta hat einen sofortigen Wirkungseintritt. Bei einer Dosierung von ca. 105 mcg/kg erzeugt Alfenta eine Hypnose, die anhand von EEG-Mustern bestimmt wird; für Alfenta wurde eine Narkose-ED90 von 182 mcg/kg bei nicht medikamentös behandelten Patienten ermittelt, basierend auf der Fähigkeit, die Reaktion auf das Anlegen eines nasopharyngealen Atemwegs zu blockieren. Auf der Grundlage klinischer Studien liegt die erforderliche Einleitungsdosis zwischen 130 und 245 mcg/kg. Bei Eingriffen, die 30-60 Minuten dauern, bewirken Ladedosen von bis zu 50 mcg/kg eine hämodynamische Reaktion auf die endotracheale Intubation und den Hautschnitt, die mit der von Fentanyl vergleichbar ist. Eine vor der Intubation verabreichte Ladedosis von 50-75 mcg/kg vor einer kontinuierlichen Infusion schwächt die Reaktion auf Laryngoskopie, Intubation und Inzision ab. Die anschließende Verabreichung einer Alfenta-Infusion mit einer Rate von 0,5-3 mcg/kg/min zusammen mit Lachgas/Sauerstoff dämpft die sympathischen Reaktionen auf chirurgischen Stress und führt zu einer schnelleren Erholung als Enfluran.
Der Bedarf an flüchtigen Inhalationsanästhetika war bei Patienten, denen Alfenta in Narkosedosen (über 130 mcg/kg) verabreicht wurde, während der ersten 60 Minuten der Aufrechterhaltung der Narkose um dreißig bis fünfzig Prozent geringer als bei Patienten, die zur Narkoseeinleitung Dosen von 4-5 mg/kg Thiopental erhielten. Bei Narkoseeinleitungsdosen sorgt Alfenta während der ersten Stunde der Narkoseerhaltung für eine tiefe Narkose und dämpft die hämodynamische Reaktion während der Intubation und des Einschnitts.
Nach einer Narkoseeinleitungsdosis von Alfenta verringert sich der Bedarf an Alfenta-Infusion in der ersten Stunde der Narkoseerhaltung um 30 bis 50 %.
Bei Patienten mit eingeschränkter Leberfunktion und bei Patienten über 65 Jahren wurde eine verringerte Plasmaclearance und eine verlängerte terminale Elimination von Alfenta festgestellt, was die postoperative Erholungsphase verlängern kann. Die wiederholte oder kontinuierliche Verabreichung von Alfenta führt zu steigenden Plasmakonzentrationen und einer Akkumulation des Arzneimittels, insbesondere bei Patienten mit verminderter Plasma-Clearance.
Bradykardie kann bei Patienten, denen Alfenta verabreicht wird, auftreten. Die Inzidenz und das Ausmaß der Bradykardie können ausgeprägter sein, wenn Alfenta in Verbindung mit nicht-vagolytischen neuromuskulären Blockern oder in Abwesenheit von anticholinergen Wirkstoffen wie Atropin verabreicht wird.
Die Verabreichung von intravenösem Diazepam unmittelbar vor oder nach hohen Dosen von Alfenta führt nachweislich zu einem Blutdruckabfall, der sekundär auf eine Vasodilatation zurückzuführen sein kann; die Erholungsphase kann auch verlängert sein.
Bei Patienten, denen Alfenta in Dosen bis zu 200 mcg/kg verabreicht wurde, wurde kein signifikanter Anstieg des Histaminspiegels und kein klinischer Hinweis auf eine Histaminfreisetzung festgestellt.
Skelettmuskelsteifigkeit hängt von der Dosis und der Geschwindigkeit der Verabreichung von Alfenta ab. Muskelsteifheit tritt unmittelbar nach der Narkoseeinleitungsdosis auf. Vorbeugende Maßnahmen (siehe WARNHINWEISE) können die Häufigkeit und den Schweregrad verringern.
Die Dauer und das Ausmaß der Atemdepression und des erhöhten Atemwegswiderstandes nehmen in der Regel mit der Dosis zu, wurden aber auch schon bei niedrigeren Dosen beobachtet. Obwohl höhere Dosen Apnoe und eine längere Dauer der Atemdepression hervorrufen können, kann Apnoe auch bei niedrigen Dosen auftreten.
Während der überwachten Anästhesiepflege (MAC) muss auf die respiratorischen Wirkungen von Alfenta Injektion geachtet werden. Verminderte Sauerstoffsättigung, Apnoe, verminderte Atemfrequenz und Obstruktion der oberen Atemwege können auftreten. (Siehe WARNHINWEISE)
Indikationen und Anwendung von Alfenta
Alfenta (Alfentanilhydrochlorid) ist indiziert:
als Analgetikum, das in abgestuften Dosen bei der Aufrechterhaltung der Anästhesie mit Barbiturat/Lachgas/Sauerstoff verabreicht wird. als Analgetikum, das durch kontinuierliche Infusion mit Lachgas/Sauerstoff bei der Aufrechterhaltung der Allgemeinanästhesie verabreicht wird. als primäres Anästhetikum zur Einleitung der Anästhesie bei Patienten, die sich einer Allgemeinoperation unterziehen, bei der eine endotracheale Intubation und mechanische Beatmung erforderlich sind. als analgetische Komponente bei der überwachten Anästhesieversorgung (MAC).
Weitere Informationen zur Anwendung von Alfenta finden Sie in der Dosierungstabelle.
Kontraindikationen
Alfenta (Alfentanilhydrochlorid) ist kontraindiziert bei Patienten mit bekannter Überempfindlichkeit gegenüber dem Arzneimittel oder bekannter Unverträglichkeit gegenüber anderen Opioid-Agonisten.
Warnhinweise
Alfenta DARF NUR VON PERSONEN VERABREICHT WERDEN, DIE SPEZIFISCH IM GEBRAUCH VON INTRAVENTIONELLEN UND ALLGEMEINEN ANÄSTHETIKUMEN UND IN DER BEHANDLUNG DER RESPIRATISCHEN WIRKUNGEN POTENTIGER OPIOIDE AUSGEBILDET SIND.
EIN OPIOID-ANTAGONIST, WIEDERBELEBUNGS- UND INTUBATIONSGERÄTE SOWIE SAUERSTOFF SOLLTEN SOFORT VERFÜGBAR SEIN.
AUFGRUND DER MÖGLICHKEIT EINER VERZÖGERTEN ATEMDEPRESSION MUSS DIE ÜBERWACHUNG DES PATIENTEN AUCH NACH DER OPERATION FORTGESETZT WERDEN.
Alfenta (Alfentanilhydrochlorid), verabreicht in Anfangsdosen von bis zu 20 mcg/kg, kann eine Skelettmuskelstarre, insbesondere der Rumpfmuskulatur, verursachen. Das Auftreten und der Schweregrad der Muskelstarre ist in der Regel dosisabhängig. Die Verabreichung von Alfenta in Narkoseeinleitungsdosen (über 130 mcg/kg) führt durchweg zu Muskelsteifheit mit sofortigem Beginn. Der Beginn der Muskelstarre tritt früher ein als bei anderen Opioiden. Alfenta kann eine Muskelstarre hervorrufen, die alle Skelettmuskeln, einschließlich der Nacken- und Extremitätenmuskeln, betrifft. Die Inzidenz kann verringert werden durch: 1) routinemäßige Verabreichung von neuromuskulären Blockern für eine ausgewogene Opioidanästhesie; 2) Verabreichung von bis zu 1/4 der vollen lähmenden Dosis eines neuromuskulären Blockers unmittelbar vor der Verabreichung von Alfenta in Dosierungen bis zu 130 mcg/kg; nach Verlust des Bewusstseins sollte eine volle lähmende Dosis eines neuromuskulär blockierenden Mittels verabreicht werden; oder 3) gleichzeitige Verabreichung von Alfenta und einer vollen lähmenden Dosis eines neuromuskulär blockierenden Mittels, wenn Alfenta in schnell verabreichten Anästhesiedosen (über 130 mcg/kg) verwendet wird.
Der verwendete neuromuskuläre Blocker sollte dem kardiovaskulären Status des Patienten angemessen sein. Für die postoperative Überwachung und Beatmung von Patienten, denen Alfenta verabreicht wurde, sollten geeignete Einrichtungen vorhanden sein. Es ist wichtig, dass diese Einrichtungen vollständig ausgestattet sind, um mit allen Graden der Atemdepression umgehen zu können.
PATIENTEN, DIE EINE ÜBERWACHTE ANÄSTHESIEVERSORGUNG (MAC) ERHALTEN, SOLLTEN KONTINUIERLICH VON PERSONEN ÜBERWACHT WERDEN, DIE NICHT AN DER DURCHFÜHRUNG DES CHIRURGISCHEN ODER DIAGNOSTISCHEN VERFAHRENS BETEILIGT SIND; SAUERSTOFFERGÄNZUNG SOLLTE SOFORT VERFÜGBAR SEIN UND BEREITGESTELLT WERDEN, WENN DIES KLINISCH ANGEZEIGT IST; DIE SAUERSTOFFSÄTTIGUNG SOLLTE KONTINUIERLICH ÜBERWACHT WERDEN; DER PATIENT SOLLTE AUF FRÜHE ANZEICHEN VON HYPOTONIE, APNOE, OBSTRUKTION DER OBEREN ATEMWEGE UND/ODER SAUERSTOFFENTSÄTTIGUNG BEOBACHTET WERDEN.
Eine schwere und unvorhersehbare Potenzierung von Monoaminoxidase (MAO)-Hemmern wurde bei anderen Opioid-Analgetika und selten bei Alfentanil berichtet. Daher wird bei der Verabreichung von Alfentanil an Patienten, die innerhalb von 14 Tagen MAO-Hemmer erhalten haben, eine angemessene Überwachung und die Verfügbarkeit von Vasodilatatoren und Betablockern zur Behandlung von Bluthochdruck empfohlen.
Vorsichtsmaßnahmen
VERZÖGERTE ATMUNGSDEPRESSION, ATMUNGSSTILLSTAND, BRADYKARDIE, ASYSTOLE, ARRHYTHMIEN und HYPOTENSION WURDEN AUCH BERICHTET.
Allgemein
Die Anfangsdosis von Alfenta (Alfentanilhydrochlorid) sollte bei älteren und geschwächten Patienten angemessen reduziert werden. Die Wirkung der Anfangsdosis sollte bei der Festlegung zusätzlicher Dosen berücksichtigt werden. Bei fettleibigen Patienten (mehr als 20 % über dem idealen Gesamtkörpergewicht) sollte die Dosierung von Alfenta auf der Grundlage des mageren Körpergewichts bestimmt werden.
In einer klinischen Studie war die Dosis von Alfenta, die zur Erzeugung einer Anästhesie erforderlich war, wie durch das Auftreten von Deltawellen im EEG bestimmt, bei geriatrischen Patienten um 40 % niedriger als bei gesunden jungen Patienten.
Bei Patienten mit eingeschränkter Leberfunktion und bei geriatrischen Patienten kann die Plasma-Clearance von Alfenta reduziert sein und die postoperative Erholung kann sich verlängern.
Induktionsdosen von Alfenta sollten langsam (über drei Minuten) verabreicht werden. Die Verabreichung kann zu einem Verlust des Gefäßtonus und zu Hypotonie führen. Vor der Einleitung sollte ein Flüssigkeitsersatz in Erwägung gezogen werden.
Diazepam, das unmittelbar vor oder in Verbindung mit hohen Alfenta-Dosen verabreicht wird, kann eine Vasodilatation und Hypotonie hervorrufen und zu einer verzögerten Erholung führen.
Die durch Alfenta verursachte Bradykardie kann mit Atropin behandelt werden. Schwere Bradykardie und Asystolie wurden erfolgreich mit Atropin und konventionellen Wiederbelebungsmethoden behandelt.
Die hämodynamischen Wirkungen eines bestimmten Muskelrelaxans und der erforderliche Grad der Skelettmuskelrelaxation sollten bei der Auswahl eines neuromuskulären Blockers berücksichtigt werden.
Nach einer Narkoseeinleitungsdosis von Alfenta wird der Bedarf an flüchtigen Inhalationsanästhetika oder Alfenta-Infusionen in der ersten Stunde der Aufrechterhaltung um 30 bis 50 % reduziert.
Alfenta-Infusionen sollten während der Allgemeinanästhesie mindestens 10-15 Minuten vor dem Ende der Operation abgesetzt werden. Während der Verabreichung von Alfenta im Rahmen der überwachten Anästhesie kann die Infusion bis zum Ende des Eingriffs fortgesetzt werden.
Die durch Opioid-Analgetika verursachte Atemdepression kann durch Opioid-Antagonisten wie Naloxon aufgehoben werden. Da die Dauer der durch Alfenta hervorgerufenen Atemdepression länger sein kann als die Dauer der Wirkung des Opioidantagonisten, sollte eine angemessene Überwachung erfolgen. Wie bei allen potenten Opioiden geht die starke Analgesie mit einer Atemdepression und einer verminderten Empfindlichkeit gegenüber CO2-Stimulation einher, die bis in die postoperative Phase anhalten oder wiederkehren können. Intraoperative Hyperventilation kann die postoperative Reaktion auf CO2 weiter verändern. Eine angemessene postoperative Überwachung sollte durchgeführt werden, insbesondere nach Infusionen und hohen Alfenta-Dosen, um sicherzustellen, dass eine adäquate Spontanatmung etabliert und ohne Stimulation aufrechterhalten wird, bevor der Patient aus dem Aufwachraum entlassen wird.
Kopfverletzungen
Alfenta sollte bei Patienten mit Kopfverletzungen oder erhöhtem intrakraniellen Druck aufgrund des erhöhten Risikos einer Atemdepression mit Vorsicht angewendet werden. Wie bei allen Opioiden kann Alfenta den klinischen Verlauf von Patienten mit Kopfverletzungen verschleiern und sollte nur angewendet werden, wenn dies klinisch indiziert ist.
Beeinträchtigte Atmung
Alfenta sollte bei Patienten mit Lungenerkrankungen, verminderter Atemreserve oder potentiell beeinträchtigter Atmung mit Vorsicht angewendet werden. Bei solchen Patienten können Opioide den Atemantrieb zusätzlich verringern und den Atemwegswiderstand erhöhen. Während der Anästhesie kann dies durch unterstützte oder kontrollierte Atmung gemanagt werden.
Eingeschränkte Leber- oder Nierenfunktion
Bei Patienten mit Leber- oder Nierenfunktionsstörungen sollte Alfenta aufgrund der Bedeutung dieser Organe für den Metabolismus und die Ausscheidung von Alfenta mit Vorsicht verabreicht werden.
Wechselwirkungen mit Arzneimitteln
Ausmaß und Dauer der Wirkungen auf das zentrale Nervensystem und das Herz-Kreislauf-System können verstärkt werden, wenn Alfenta in Kombination mit anderen ZNS-deprimierenden Mitteln wie Barbituraten, Beruhigungsmitteln, Opioiden oder Inhalationsnarkotika verabreicht wird. Die postoperative Atemdepression kann durch diese Mittel verstärkt oder verlängert werden. In solchen Fällen einer kombinierten Behandlung sollte die Dosis eines oder beider Wirkstoffe reduziert werden. Begrenzte klinische Erfahrungen deuten darauf hin, dass der Bedarf an flüchtigen Inhalationsanästhetika in den ersten sechzig (60) Minuten nach der Alfenta-Induktion um 30 bis 50 % reduziert ist.
Die gleichzeitige Anwendung von Erythromycin mit Alfenta kann die Alfenta-Clearance signifikant hemmen und das Risiko einer verlängerten oder verzögerten Atemdepression erhöhen.
Cimetidin reduziert die Clearance von Alfenta. Daher sind bei längerer Verabreichung geringere Alfenta-Dosen erforderlich und die Wirkungsdauer von Alfenta kann sich verlängern.
Die präoperative Verabreichung von Arzneimitteln, die die Leberdurchblutung oder die Enzymfunktion beeinflussen, kann die Plasmaclearance verringern und die Genesung verlängern.
Karzinogenese, Mutagenese und Beeinträchtigung der Fruchtbarkeit
Es wurden keine Langzeitstudien an Tieren mit Alfenta durchgeführt, um das karzinogene Potenzial zu bewerten. Im In-vivo-Mikronukleustest an weiblichen Ratten wurden keine strukturellen Chromosomenmutationen bei einer intravenösen Einzeldosis von Alfenta von bis zu 20 mg/kg Körpergewicht (etwa das 40-fache der oberen Humandosis) erzeugt, was einer Dosis von 103 mg/m2 Körperoberfläche entspricht. Im In-vivo-Dominant-Letaltest an männlichen und weiblichen Mäusen wurden bei der maximalen intravenösen Dosis von 20 mg/kg (60 mg/m2) keine dominant-tödlichen Mutationen erzeugt. Im In-vitro-Ames-Salmonella-Typhimurium-Test mit und ohne Stoffwechselaktivierung wurde keine mutagene Aktivität festgestellt.
Schwangerschaftskategorie C
Alfenta hat nachweislich eine embryozide Wirkung bei Ratten und Kaninchen, wenn es in Dosen verabreicht wurde, die das 2,5-fache der menschlichen Höchstdosis über einen Zeitraum von 10 bis über 30 Tagen betragen. Diese Wirkungen könnten auf eine maternale Toxizität (verminderte Nahrungsaufnahme mit erhöhter Sterblichkeit) nach längerer Verabreichung des Arzneimittels zurückzuführen sein.
Nach der Verabreichung von Alfenta an Ratten oder Kaninchen wurden keine Hinweise auf teratogene Wirkungen beobachtet.
Es gibt keine angemessenen und gut kontrollierten Studien an schwangeren Frauen. Alfenta sollte während der Schwangerschaft nur angewendet werden, wenn der potentielle Nutzen das potentielle Risiko für den Fötus rechtfertigt.
Labor und Entbindung
Es liegen keine ausreichenden Daten vor, um die Anwendung von Alfenta bei der Entbindung zu unterstützen. Es wurde über eine plazentare Übertragung des Arzneimittels berichtet; daher wird die Anwendung bei Wehen und Geburt nicht empfohlen.
Stillende Mütter
In einer Studie mit neun Frauen, die sich einer postpartalen Tubenligatur unterzogen, wurden vier Stunden nach Verabreichung von 60 mcg/kg Alfenta signifikante Alfenta-Spiegel im Kolostrum nachgewiesen, wobei nach 28 Stunden keine nachweisbaren Spiegel mehr vorhanden waren. Vorsicht ist geboten, wenn Alfenta einer stillenden Frau verabreicht wird.
Anwendung bei Kindern
Zurzeit liegen keine ausreichenden Daten zur Unterstützung der Anwendung von Alfenta bei Kindern unter 12 Jahren vor.
Nebenwirkungen
Die häufigsten Nebenwirkungen von Opioiden sind Atemdepression und Skelettmuskelsteifigkeit, insbesondere der Rumpfmuskulatur. Alfenta kann eine Muskelstarre hervorrufen, die die Skelettmuskulatur des Halses und der Extremitäten betrifft. Siehe KLINISCHE PHARMAKOLOGIE, WARNHINWEISE und VORSICHTSMASSNAHMEN zum Umgang mit Atemdepression und Skelettmuskelstarre.
Das Profil der unerwünschten Wirkungen bei 696 Patienten, die Alfenta im Rahmen der überwachten Anästhesie (MAC) erhielten, ähnelt dem Profil, das bei Alfenta während der Allgemeinanästhesie festgestellt wurde. Zu den während der MAC berichteten respiratorischen Ereignissen gehörten Hypoxie, Apnoe und Bradypnoe. Andere unerwünschte Ereignisse, die von Patienten, die Alfenta für die MAC erhielten, berichtet wurden, waren, in der Reihenfolge ihrer abnehmenden Häufigkeit, Übelkeit, Hypotonie, Erbrechen, Pruritus, Verwirrung, Somnolenz und Unruhe.
Die folgenden Informationen über unerwünschte Wirkungen stammen aus kontrollierten und offenen klinischen Studien an 785 Patienten, die intravenös Alfenta während der Einleitung und Aufrechterhaltung einer Allgemeinanästhesie erhielten. Die kontrollierten Studien umfassten Behandlungsvergleiche mit Fentanyl, Thiopental-Natrium, Enfluran, Kochsalzlösung-Placebo und Halothan. Die Häufigkeit bestimmter Nebenwirkungen hängt von der Art der Anwendung ab, z. B. wurde in klinischen Studien zur Alfentanil-Einleitung häufiger über Brustwandsteifigkeit berichtet, und von der Art des Eingriffs, z. B. traten Übelkeit und Erbrechen häufiger bei Patienten auf, die sich einer gynäkologischen Operation unterzogen. Die Gesamtberichte über Übelkeit und Erbrechen unter Alfenta waren mit denen von Fentanyl vergleichbar.
Inzidenz größer als 1 % – wahrscheinlich ursächlich (abgeleitet aus klinischen Studien)
| * Inzidenz 3 % bis 9 % Alle anderen 1 % bis 3 % |
|
| Gastrointestinal: | Übelkeit (28%), Erbrechen (18%) |
| Kardiovaskulär: | Arrhythmie, Bradykardie (14%), Bluthochdruck (18%), Bluthochdruck (10%), Tachykardie (12%) |
| Muskuloskelettale: | Brustwandsteifigkeit (17%), Skelettmuskelbewegungen* |
| Atmung: | Apnoe*, postoperative Atemdepression |
| Zentrales Nervensystem: | unscharfes Sehen, Schwindel*, Schläfrigkeit/postoperative Sedierung |
Inzidenz weniger als 1 % – wahrscheinlich ursächlich (abgeleitet aus klinischen Studien)
Nebenwirkungen, die im Rahmen der Anwendungsbeobachtung berichtet wurden und in klinischen Studien nicht beobachtet wurden, sind kursiv gedruckt.
| * Inzidenz 0.3% bis 1% | |
| Gesamtkörper: | Anaphylaxie |
| Zentrales Nervensystem: | Kopfschmerzen*, myoklonische Bewegungen, postoperative Verwirrung*, postoperative Euphorie*, Zittern* |
| Dermatologisch: | Juckreiz*, Urtikaria* |
| Injektionsstelle: | Schmerzen* |
| Muskuloskeletal: | Skelettmuskelsteifigkeit des Halses und der Extremitäten |
| Respiratorisch: | Bronchospasmus, Hyperkarbie*, Laryngospasmus* |
Drogenmissbrauch und -abhängigkeit
Alfenta (Alfentanilhydrochlorid) ist eine kontrollierte Substanz der Liste II, die eine Abhängigkeit vom Morphintyp hervorrufen kann und daher das Potenzial hat, missbraucht zu werden.
Opioid-Analgetika wurden mit Missbrauch und Abhängigkeit bei Leistungserbringern im Gesundheitswesen und anderen Personen mit leichtem Zugang zu solchen Medikamenten in Verbindung gebracht. Alfenta sollte entsprechend gehandhabt werden.
Überdosierung
Eine Überdosierung würde sich wie bei anderen starken Opioid-Analgetika durch eine Verlängerung der pharmakologischen Wirkung von Alfenta (Alfentanilhydrochlorid) manifestieren (siehe KLINISCHE PHARMAKOLOGIE). Während der klinischen Studien wurden keine Erfahrungen mit einer Überdosierung mit Alfenta berichtet. Die intravenöse LD50 von Alfenta beträgt 43-51 mg/kg bei Ratten, 72-74 mg/kg bei Mäusen, 72-82 mg/kg bei Meerschweinchen und 60-88 mg/kg bei Hunden. Die intravenöse Verabreichung eines Opioidantagonisten wie Naloxon sollte als spezifisches Antidot zur Beherrschung der Atemdepression eingesetzt werden.
Die Dauer der Atemdepression nach Überdosierung mit Alfenta kann länger sein als die Wirkungsdauer des Opioidantagonisten. Die Verabreichung eines Opioidantagonisten sollte die sofortige Herstellung eines freien Atemweges, die Verabreichung von Sauerstoff und die unterstützte oder kontrollierte Beatmung, wie sie bei Hypoventilation oder Apnoe angezeigt ist, nicht ausschließen. Wenn die Atemdepression mit Muskelsteifheit einhergeht, kann ein neuromuskulärer Blocker erforderlich sein, um die assistierte oder kontrollierte Beatmung zu erleichtern. Intravenöse Flüssigkeiten und vasoaktive Substanzen können erforderlich sein, um die hämodynamische Instabilität zu kontrollieren.
Alfenta Dosierung und Verabreichung
Die Dosierung von Alfenta (Alfentanilhydrochlorid) sollte individuell angepasst und auf die gewünschte Wirkung bei jedem Patienten entsprechend dem Körpergewicht, dem körperlichen Zustand, dem zugrundeliegenden pathologischen Zustand, der Verwendung anderer Medikamente sowie der Art und Dauer des chirurgischen Eingriffs und der Anästhesie titriert werden. Bei fettleibigen Patienten (mehr als 20% über dem idealen Gesamtkörpergewicht) sollte die Dosierung von Alfenta auf der Grundlage des mageren Körpergewichts festgelegt werden. Die Dosis von Alfenta sollte bei älteren oder geschwächten Patienten reduziert werden (siehe VORSICHTSMASSNAHMEN).
Die Vitalzeichen sollten routinemäßig überwacht werden.
Siehe Dosierungsrichtlinien für die Anwendung von Alfenta: 1) durch inkrementelle Injektion als analgetische Ergänzung zur Anästhesie mit Barbiturat/Lachgas/Sauerstoff bei kurzen chirurgischen Eingriffen (erwartete Dauer von weniger als einer Stunde); 2) durch kontinuierliche Infusion als Erhaltungsanalgetikum mit Lachgas/Sauerstoff bei allgemeinen chirurgischen Eingriffen; und 3) durch intravenöse Injektion in Narkosedosen für die Einleitung der Anästhesie bei allgemeinen chirurgischen Eingriffen mit einer voraussichtlichen Dauer von mindestens 45 Minuten; und 4) durch intravenöse Injektion als analgetische Komponente für die überwachte Anästhesiepflege (MAC).
| DIE DOSIERUNG SOLLTE INDIVIDUELL ANGEPASST UND TITRIERT WERDEN | |
|---|---|
| ZUR ANWENDUNG WÄHREND DER ALLGEMEINEN ANÄSTHESIE | |
| SPONTANES ATMEN/ASSISTIERTE VENTILATION | Induktion der Analgesie: 8-20 mcg/kg Aufrechterhaltung der Analgesie: 3-5 mcg/kg q 5-20 min oder 0.5 bis 1 mcg/kg/min Gesamtdosis: 8-40 mcg/kg |
| ASSISTIERTE ODER KONTROLLIERTE VENTILATION | |
| Inkrementelle Injektion (Zur Abschwächung der Reaktion auf Laryngoskopie und Intubation) |
Induktion der Analgesie: 20-50 mcg/kg Aufrechterhaltung der Analgesie: 5-15 mcg/kg q 5-20 min Gesamtdosis: Bis zu 75 mcg/kg |
| Dauerinfusion (Zur Abschwächung der Reaktion auf Intubation und Schnitt) |
Die Infusionsraten sind variabel und sollten entsprechend der gewünschten klinischen Wirkung titriert werden. Siehe Dosierungsrichtlinien für die Infusion unten. Induktion der Analgesie: 50-75 mcg/kg Aufrechterhaltung der Analgesie: 0,5 bis 3 mcg/kg/min (durchschnittliche Rate 1 bis 1,5 mcg/kg/min) Gesamtdosis: Abhängig von der Dauer des Eingriffs |
| Anästhesieeinleitung | Anästhesieeinleitung: 130-245 mcg/kg Aufrechterhaltung der Anästhesie: 0,5 bis 1,5 mcg/kg/min oder Vollnarkose Gesamtdosis: Abhängig von der Dauer des Eingriffs Bei diesen Dosen ist mit einer Rumpfsteifigkeit zu rechnen und ein Muskelrelaxans sollte verwendet werden. Langsam verabreichen (über 3 Minuten). Konzentration der Inhalationsmittel in der ersten Stunde um 30-50% reduziert. |
| MONITORED ANESTHESIA CARE (MAC) (Für sedierte und ansprechbare, spontan atmende Patienten) |
Induktion von MAC: 3-8 mcg/kg Aufrechterhaltung von MAC: 3-5 mcg/kg q 5-20 min oder 0.25 bis 1 mcg/kg/min Gesamtdosis: 3-40 mcg/kg |
Dauerinfusion: 0,5-3 mcg/kg/min verabreicht mit Lachgas/Sauerstoff bei Patienten, die sich einer allgemeinen Operation unterziehen. Nach einer Narkoseeinleitungsdosis von Alfenta werden die Anforderungen an die Infusionsrate in der ersten Stunde der Aufrechterhaltung um 30-50% reduziert.
Veränderungen der Vitalzeichen, die auf eine Reaktion auf chirurgischen Stress oder eine Auflockerung der Narkose hindeuten, können durch Erhöhung der Alfentanil-Dosis auf maximal 4 mcg/kg/min und/oder Verabreichung von Bolusdosen von 7 mcg/kg kontrolliert werden. Wenn sich die Veränderungen nach drei Bolusdosen, die über einen Zeitraum von fünf Minuten verabreicht werden, nicht kontrollieren lassen, sollte ein Barbiturat, ein Vasodilatator und/oder ein Inhalationsmittel eingesetzt werden. Beim Ausbleiben dieser Anzeichen sollte die Infusionsgeschwindigkeit immer nach unten korrigiert werden, bis eine Reaktion auf die chirurgische Stimulation erfolgt.
Anstatt die Infusionsgeschwindigkeit zu erhöhen, sollten 7 mcg/kg Bolusdosen von Alfenta oder ein starkes Inhalationsmittel als Reaktion auf Anzeichen einer Aufhellung der Anästhesie innerhalb der letzten 15 Minuten der Operation verabreicht werden. Die Alfenta-Infusion sollte mindestens 10-15 Minuten vor dem Ende der Operation abgesetzt werden.
Anwendung bei Kindern
Klinische Daten zur Unterstützung der Anwendung von Alfenta bei Patienten unter 12 Jahren liegen derzeit nicht vor. Daher wird eine solche Anwendung nicht empfohlen.
Prämedikation
Die Auswahl der präanästhetischen Medikamente sollte sich an den Bedürfnissen des einzelnen Patienten orientieren.
Neuromuskuläre Blocker
Der ausgewählte neuromuskuläre Blocker sollte mit dem Zustand des Patienten kompatibel sein, wobei die hämodynamischen Wirkungen eines bestimmten Muskelrelaxans und der Grad der erforderlichen Skelettmuskelrelaxation zu berücksichtigen sind (siehe Abschnitte KLINISCHE PHARMAKOLOGIE, WARNUNGEN und VORSICHTSMASSNAHMEN).
Bei Patienten, denen Alfenta in einer Narkosedosis (Induktionsdosis) verabreicht wird, ist es wichtig, dass qualifiziertes Personal und angemessene Einrichtungen für das Management der intraoperativen und postoperativen Atemdepression zur Verfügung stehen.
Siehe auch Abschnitte WARNHINWEISE und VORSICHTSMASSNAHMEN.
Für die genaue Verabreichung kleiner Mengen von Alfenta wird die Verwendung einer Tuberkulinspritze oder einer gleichwertigen Spritze empfohlen.
Die physikalische und chemische Kompatibilität von Alfenta wurde in Lösung mit normaler Kochsalzlösung, 5% Dextrose in normaler Kochsalzlösung, 5% Dextrose in Wasser und Lactated Ringers nachgewiesen. Klinische Studien zur Alfenta-Infusion wurden mit Alfenta verdünnt in einem Konzentrationsbereich von 25 mcg/mL bis 80 mcg/mL durchgeführt.
Als Beispiel für die Zubereitung von Alfenta zur Infusion werden 20 mL Alfenta zu 230 mL Verdünnungsmittel hinzugefügt, was eine Lösung von 40 mcg/mL Alfenta ergibt.
Parenteralarzneimittel sollten vor der Verabreichung visuell auf Partikel und Verfärbungen untersucht werden, sofern Lösung und Behältnis dies zulassen.
SICHERHEIT UND HANDHABUNG
Alfenta (Alfentanilhydrochlorid) wird in einzeln versiegelten Darreichungsformen geliefert, die kein bekanntes Risiko für den zufälligen Kontakt mit Gesundheitsdienstleistern darstellen. Ein versehentlicher Hautkontakt mit Alfenta sollte durch Spülen der betroffenen Stelle mit Wasser behandelt werden.
Vor Licht schützen. Lagerung: Bei 20° bis 25°C (68° bis 77°F) lagern.
Wie wird Alfenta geliefert
Alfenta (Alfentanilhydrochlorid) Injektion zur intravenösen Anwendung. Jeder mL enthält: Aktiv: Alfentanil-Base 500 mcg. Unwirksame Bestandteile: Natriumchlorid 9 mg und WFI Q.S. Alfenta Injektion ist erhältlich als:
NDC 11098-060-02, 2 mL Ampulle in 10er-Packungen
NDC 11098-060-05, 5 mL Ampulle in 10er-Packungen
NDC 11098-060-10, 10 mL Ampulle in 5er-Packungen
NDC 11098-060-20, 20 mL Ampulle in 5er-Packungen
U.S. Patent Nr. 4,167,574
Mai 1995, November 1995
TAYLOR PHARMACEUTICALS
AN AKORN COMPANY
Decatur, IL 62522
AFA0N Rev. 06/05
| Alfenta Alfentanilhydrochlorid-Injektion |
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||
Etikettierer – TAYLOR PHARMACEUTICALS