Aplastic anemia pathophysiology
Aplastic anemia Microchapters
Home
Patient Information
Overview
Historical Perspective
Classification
Pathophysiology
Causes
Differentiating Aplastische Anämie von other Diseases
Epidemiology and Demographics
Risk Factors
Screening
Natural History, Complications and Prognosis
Diagnosis
Diagnostic Study of Choice
History and Symptoms
Physical Examination
Laboratory Findings
Electrocardiogram
Chest X Ray
CT
MRI
Echocardiography or Ultrasound
Other Imaging Findings
Other Diagnostic Studies
Treatment
Medical Therapy
Surgery
Primary Prevention
Secondary Prevention
Cost-Effectiveness of Therapy
Future or Investigational Therapies
Case Studies
Case #1
Aplastic anemia pathophysiology On the Web
Most recent articles
cited articles
Review articles
CME Programs
Powerpoint Slides
Images
American Roentgen Ray Society Images of Aplastic anemia pathophysiology
All Images X-rays Echo & Ultraschall CT Bilder MRI
Laufende Studien bei Clinical Trials.gov
US National Guidelines Clearinghouse
NICE Guidance
FDA zur Pathophysiologie der aplastischen Anämie
CDC zur Pathophysiologie der aplastischen Anämie
Aplastische Pathophysiologie der aplastischen Anämie in den Nachrichten
Blogs zur Pathophysiologie der aplastischen Anämie
Wegweiser zu Krankenhäusern Behandlung der aplastischen Anämie
Risikorechner und Risikofaktoren für die Pathophysiologie der aplastischen Anämie
Herausgeber-Chefredakteur: C. Michael Gibson, M.S., M.D. ; Assoziierte(r) Chefredakteur(in): Priyamvada Singh, M.D. Nazia Fuad M.D.
Bitte helfen Sie WikiDoc, indem Sie hier Inhalte hinzufügen. It’s easy! Klicken Sie hier, um mehr über das Editieren zu erfahren.
Übersicht
Knochenmark ist ein schwammartiges Gewebe, das sich in den schwammartigen oder spongiösen Teilen der Knochen befindet. Es ist stark vaskularisiert und reichlich innerviert. Das Knochenmark ist der primäre Ort der Hämatopoese und besteht aus hämatopoetischen Zellen, Knochenmark-Fettgewebe und Stromazellen. Das wichtigste Merkmal in der Pathophysiologie der aplastischen Anämie ist der Verlust von hämatopoetischen Stammzellen. Dies kann in Form eines hämatopoetischen Versagens oder einer immunvermittelten Zerstörung des Knochenmarks erfolgen. Medikamente, Chemikalien, Viren und verschiedene Arten von Mutationen verändern das immunologische Erscheinungsbild der HSZ, was zu einer autoimmunen Zerstörung der Knochenmarkzellen führt. AA können sich allmählich zu anderen hämatologischen Erkrankungen entwickeln, darunter paroxysmale nächtliche Hämoglobinurie, myelodysplastische Syndrome und akute myeloische Leukämie.) Die klonale Evolution bei AA kann durch Mutationen oder zytogenetische Anomalien verursacht werden. Die Gene, die häufig mutiert sind, sind DMNT3A, ASXL1, BCOR, BCORL1, PIGA.
Pathophysiologie
Physiologie
Die normale Physiologie des Knochenmarks kann wie folgt verstanden werden:
- Das Knochenmark ist ein schwammartiges Gewebe, das sich in den spongiösen oder spongiösen Teilen der Knochen befindet
- Es ist stark vaskularisiert und reichlich innerviert
- Das Knochenmark ist der primäre Ort der Hämatopoese.
- Es setzt sich aus hämatopoetischen Zellen, Knochenmarkfettgewebe und Stromazellen zusammen.
- Hämatopoetische Stammzellen (HSC) im Knochenmark sind die Quelle aller reifen Zellen im peripheren Blut und in den Geweben und sind multipotent.
- HSC werden anhand ihres Immunphänotyps erkannt und isoliert.
- HSC bilden eine kleine Population innerhalb der CD34+/CD38-Fraktion der Knochenmarkzellen.
- Die Hämatopoese wird durch verschiedene Regulationsmechanismen, einschließlich Wachstumsfaktoren, gesteuert.
- Die normale Knochenmarkstruktur kann durch aplastische Anämie, bösartige Erkrankungen oder Infektionen geschädigt oder verdrängt werden.
- Das führt zu einer verminderten Produktion von Blutzellen und Blutplättchen.
Pathogenese
Das wichtigste Merkmal in der Pathophysiologie der aplastischen Anämie ist der Verlust von hämatopoetischen Stammzellen.
Zu den pathophysiologischen Mechanismen, die zum Verlust von HSZ führen und eine aplastische Anämie verursachen, gehören:
Hämatopoetisches Versagen
- CD34-Zellen sind bei der aplastischen Anämie fast nicht vorhanden.
- Vorläuferzellen, die erythroide, myeloide und megakaryozytäre Zellen bilden können, sind stark reduziert.
- Die primitiven hämatopoetischen Zellen, die eng mit den Stammzellen verwandt sind, sind durchweg mangelhaft.
- Die weißen Blutkörperchen bei der aplastischen Anämie haben kurze Telomere.
- Telomere sind Wiederholungen am Ende eines eukaryotischen Chromosoms und sind für den Chromosomenschutz und die vollständige DNA-Replikation unerlässlich.
Immunvermittelte T-Zell-Zerstörung des Knochenmarks
-
- Drogen, Chemikalien, Viren und verschiedene Mutationen verändern das immunologische Erscheinungsbild von HSCs, was zu einer autoimmunen Zerstörung von Knochenmarkzellen führt.
- Bei Patienten mit erworbener aplastischer Anämie sind Lymphozyten für die Zerstörung der hämatopoetischen Zellen verantwortlich.
- Diese T-Zellen produzieren einen inhibitorischen Faktor, Interferone, Tumornekrosefaktor und Interleukin-2, was zum Tod der hämatopoetischen Zellen durch Apoptose führt.
- CD4+CD25+FOXP3+ regulatorische T-Zellen sind bei diesen Patienten unzureichend, ähnlich wie bei anderen Autoimmunerkrankungen.
- Der Mangel an diesen regulatorischen T-Zellen führt zu einem Anstieg des T-bet-Proteins in den T-Zellen, einem erhöhten Interferon (IFN)-γ,2 und einer Zerstörung der Stammzellen.
- Erhöhte Immunreaktionen, einschließlich Tumor-Nekrose-Faktor-α, IFNγ und Interleukin-6, sind bei AA-Patienten ebenfalls sehr häufig.
Klonale Entwicklung
- AA kann sich allmählich zu anderen hämatologischen Störungen entwickeln, zu denen
-
- Paroxysmale nächtliche Hämoglobinurie
- Myelodysplastische Syndrome
- Akute myeloische Leukämie
- Eine klonale Entwicklung bei AA kann aufgrund von Mutationen oder zytogenetischen Anomalien auftreten.
- Die Gene, die häufig mutiert sind, sind
- DMNT3A
- ASXL1
- BCOR
- BCORL1
- PIGA
Genetik
Zu den Genen, die an der Entstehung der aplastischen Anämie beteiligt sind, gehören:
- HLA-DR15
- CD4+ CD25+ FOXP3+ regulatorische T-Zellen
- STAT3
- TERT
- TERC
Assoziierte Erkrankungen
Aplastische Anämie ist mit folgenden Erkrankungen assoziiert:
- Fanconi-Anämie
- PNH Paroxysmale nächtliche Hämoglobinurie
Grosspathologie
Aplastische Anämie zeigt keine grobe Pathologie
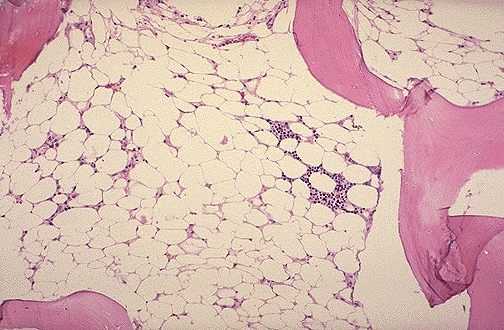
Mikroskopische Pathologie
Bei der aplastischen Anämie zeigt die Mikroskopie des Knochenmarks eine Hypo- und sogar Azellularität, Fettgewebe und ein blasses Stroma.
- Hays K (Februar 1990). „Physiology of normal bone marrow“. Semin Oncol Nurs. 6 (1): 3-8. PMID 2406826.
- Bacigalupo A (2007). „Aplastische Anämie: Pathogenese und Behandlung“. Hematology Am Soc Hematol Educ Program: 23–8. doi:10.1182/asheducation-2007.1.23. PMID 18024605.
- 3.0 3.1 3.2 3.3 Brodsky, R. A. (2000). „Aplastic Anemia: Pathophysiologie und Behandlung“. Zeitschrift des Nationalen Krebsinstituts. 92 (9): 754-754. doi:10.1093/jnci/92.9.754. ISSN 1460-2105.
- 4.0 4.1 Young, Neal S. (2002). „Acquired Aplastic Anemia“. Annals of Internal Medicine. 136 (7): 534. doi:10.7326/0003-4819-136-7-200204020-00011. ISSN 0003-4819.