Fronteras en la Neurociencia de Sistemas
Los cambios en el estado cerebral están asociados con los cambios de microcircuitos en las propiedades de disparo neuronal y con los cambios a nivel macro en los patrones sincrónicos o asincrónicos de la activación cerebral. En este marco, los axones han sido relativamente menos investigados (Barry, 2015), y entonces principalmente en el contexto de la velocidad de conducción de los potenciales de acción y el aumento del estado de alerta que puede resultar de los cambios en la velocidad de conducción (por ejemplo, Stoelzel et al., 2017). Además, sin embargo, la topología altamente ramificada de muchos axones parece bien diseñada para reclutar diferencialmente grupos neuronales postsinápticos distribuidos, posiblemente de manera dependiente del estado. El procesamiento de la señal puede efectuarse en al menos tres dominios axonales; a saber, el mapeo, la amplificación y la temporización (Innocenti et al., 2016; Innocenti, 2017). En esta Perspectiva, discuto brevemente primero, ejemplos de redes de colateralización de axones, y luego algunas de las características intrínsecas de los axones que podrían subyacer al reclutamiento postsináptico diferencial. Al carecer de parámetros o mecanismos detallados, el objetivo es principalmente destacar las características generales que podrían figurar en el control y las transiciones de los estados cerebrales.
- Colaterales de los axones
- Colateralización no estereotipada
- Colaterales intrínsecas
- Un ejemplo interesante: Las células de Meynert en el área V1 de los primates no humanos
- Significado funcional de la ramificación de los axones
- Propiedades dinámicas de los axones
- Conclusión
- Contribuciones del autor
- Financiación
- Declaración de conflicto de intereses
Colaterales de los axones
Todos los axones tienen una elaborada arborización distal en la estructura de destino. Muchos axones, además, tienen múltiples ramificaciones (aka, colaterales) que se dirigen a estructuras claramente diferentes (revisado en Rockland, 2013, 2018). Un ejemplo destacado es la ramificación de los axones de las neuronas corticotalámicas de capa 5. Esto se ha documentado repetidamente y a menudo se discute como un mecanismo clave por el que un organismo puede distinguir si los cambios en la entrada sensorial son producidos por cambios en el entorno o por movimientos autoiniciados («copia de eferencia» o «descarga colateral», Guillery y Sherman, 2011).
En roedores, donde hay un gran número de técnicas aplicables para investigar esta cuestión, se sabe que la colateralización es relativamente común. Por poner varios ejemplos: (1) las neuronas del subículo del hipocampo se proyectan a los cuerpos mamilares, a la corteza retrosplenial o por colaterales a ambos (rata: Kinnavane et al, 2018); (2) las neuronas serotoninérgicas del núcleo del rafe dorsal (DR) contactan en varias combinaciones con el estriado, la corteza prefrontal y la amígdala (rata: Gagnon y Parent, 2014), así como con combinaciones de núcleos autonómicos (Waselus et al., 2011). En este caso, la activación de la respuesta al estrés por parte de las colaterales del RD podría lograr una activación sincronizada de los núcleos asociados a la liberación de neurohormonas o a las respuestas presoras. Las activaciones diferenciales y coordinadas de las estructuras del cerebro anterior pueden contribuir a las multifacéticas pero relacionadas funciones del RD, como la regulación del ciclo sueño-vigilia, la modulación de las señales de dolor o la expresión del estado de ánimo (Gagnon y Parent, 2014).
En tercer lugar, los estudios anatómicos de las proyecciones talamocorticales de los ratones identifican «axones multiespecíficos» que se ramifican ampliamente hacia dominios restringidos en áreas corticales (y subcorticales) separadas. Se ha planteado la hipótesis de que estos orquestan la rápida aparición y reconfiguración de conjuntos neuronales espacialmente distribuidos y sincronizables (Clasca et al., 2016).
En cuarto lugar, un estudio reciente de las conexiones corticocorticales mediante el rastreo axonal de todo el cerebro en la corteza visual de los ratones descubrió que 23 de 30 neuronas se pusieron en contacto de dos a siete otras áreas corticales. En confirmación de este resultado, la secuenciación de ADN de alto rendimiento de las neuronas con código de barras genético encontró que el 44% de las 533 neuronas se proyectaban de forma múltiple («neuronas de transmisión», Han et al., 2018). Han et al. distinguieron provisionalmente dos amplios tipos de neuronas de proyección, una subpoblación más pequeña «dedicada» (uni-objetivo), que coexiste con una prevalencia de células «de difusión» (de proyección múltiple). ¿Podría esta arquitectura servir para las modulaciones en el estado cognitivo y el procesamiento sensorial?
Colateralización no estereotipada
Como se ha señalado anteriormente, las neuronas que colateralizan lo hacen en un patrón no estereotipado. Dentro de una proyección designada (definida por el origen), las neuronas envían ramas a un subconjunto diversificado de áreas objetivo («en todas las combinaciones»). Esta observación es tan consistente que puede considerarse una regla, aunque no se han tabulado los parámetros detallados. El significado funcional tampoco está claro, pero los resultados emergentes sugieren que las entradas heterogéneas y variables a una neurona cortical (y, por extensión, podríamos inferir a los conjuntos neuronales) son importantes para impulsar la variabilidad y los cambios del tren de picos a través de los ensayos experimentales (Gomez-Laberge et al., 2016 y ver más abajo).
Colaterales intrínsecas
En todas las especies, las neuronas de proyección cortical de larga distancia, además de objetivos extrínsecos únicos o múltiples, suelen tener una elaborada arborización intrínseca. Algunas neuronas corticales sólo tienen una colateralización intrínseca (local), y otras sólo una extrínseca (rata: Kita y Kita, 2012). Aunque solo hay escasos datos sobre las proporciones reales de arborizaciones intrínsecas y extrínsecas (Parent et al., 2000; Rockland, 2018), la evidencia sugiere que esto será muy variable. Incluso dentro del sistema de conexiones intrínsecas, no solo hay diferencias en el número de colaterales y el número de boutones sinápticos, sino que una sola neurona puede tener una mezcla de colaterales mielinizadas y no mielinizadas (corteza visual del gato: Martin et al., 2014; Koestinger et al., 2017). La mielinización específica de la rama podría dar lugar a un aumento de la velocidad de conducción específica de la rama, aunque Koestinger et al. sugieren que puede tener más que ver con factores como una mayor seguridad de la transmisión, presumiblemente, de nuevo, específica de la rama.
Una observación curiosa relacionada con la mielinización pertenece a la estría de Gennari, la banda mielinizada de axones en la capa 4B del área V1 de primates. Dado que se trata de colaterales intrínsecos, la explicación común de que la mielinización es un medio para aumentar la velocidad de conducción a largas distancias no es inmediatamente aplicable. Las colaterales locales no necesitan (?) aumentar en relación con los objetivos lejanos y, de hecho, para la sincronización que se podría haber predicho, el aumento de la conducción local (¿a través de la mielinización?) parece paradójico. ¿Podría ser que la mielinización se relacione con otros factores, tales como cambios relacionados con la plasticidad (o relacionados con el estado) en el diámetro del axón?
Un ejemplo interesante: Las células de Meynert en el área V1 de los primates no humanos
Estas grandes neuronas, en el límite de las capas 5 y 6, proyectan de forma variable al área extraestriada MT, y/o a otras áreas de asociación visual, y/o al núcleo pulvinar, y/o al colículo superior y al pretectum (Weisenhorn et al., 1995; Rockland y Knutson, 2001). La colateralización intrínseca es excepcionalmente extensa, medida como 8,0 mm desde el soma, sobre la base de reconstrucciones subtotales, y con al menos 800-1.370 boutons (Figura 1). A lo largo de la arborización axonal, parece haber una clara variabilidad en el diámetro de las ramas; es decir, las ramas extrínsecas dirigidas al área MT son grandes (diámetro ~3,0 μm), pero las ramas intrínsecas y las que se proyectan hacia el pulvinar y el colículo superior parecen más pequeñas, según la microscopía de luz (cf. Figura 1B (intrínseca) y Figura 1D (extrínseca al área MT). La variación de los diámetros indica presumiblemente diferencias en el grado de mielinización y, por inferencia, en la velocidad de conducción.
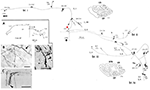
Figura 1. Arborización axonal proximal típica y espacialmente extendida de una célula de Meynert (asterisco rojo) en la corteza visual primaria de un mono macaco. Hay tres colaterales intrínsecas principales (etiquetadas como br. i, ii, iv), que se extienden 3,0 mm dorsalmente en la capa 1, 3,0 mm ventralmente en la capa 6, 4,0 mm ventralmente en la capa 6, y 0,5 mm en la capa 4B, como se indica con puntas de flecha en los dos contornos de la sección coronal (secciones 222 y 274, donde la dorsal está a la izquierda). En conjunto, las colaterales intrínsecas abarcan 5,9 mm anteroposteriormente (117 secciones × 50 μm). Otra colateral extrínseca (br. iii) se encuentra en las capas 4 y 6 del área V2. No se han podido seguir porciones de las colaterales individuales y del axón principal (flecha gruesa), como se indica con líneas discontinuas. El recuadro de bajo aumento (A, a la izquierda) proporciona una visión esquemática de la configuración general. Los números denotan secciones individuales, donde 20 números = 1,0 mm. Todas las ramas tienen numerosos grupos sinápticos pequeños, uno de los cuales se ilustra en (B). Nótese la disminución del diámetro entre el axón principal (flecha) y la arborización terminal. Los axones extrínsecos (C) son de diámetros variables (un axón de gran diámetro en la punta de la flecha). (D) Las terminaciones extrínsecas en el área MT incluyen algunos axones de gran diámetro. Barra de escala = 25 μm en (B), 100 μm en (C), 20μm en (D). CF, fisura calcarina; LS, surco lunar; STS, surco temporal superior; L, capa. Modificado de las Figuras 1, 9 de Rockland y Knutson (2001) y de las Figuras 6f, 7b de Rockland (1995) con permiso.
Significado funcional de la ramificación de los axones
Un componente importante de la colateralización es que las ramas hijas no suelen ser uniformes, sino que, especialmente en los puntos de ramificación, varían de diámetro (Figura 2). La variabilidad del diámetro, junto con otros parámetros, tendrá un impacto en la excitabilidad, la velocidad de conducción y otros aspectos de la propagación de la señal. Otros parámetros que impactan son la anchura de la mielina y la longitud intermodal, y la densidad y distribución de los canales iónicos (revisados en Debanne et al., 2011; Seidl, 2014; Bucher, 2016; Seidl y Rubel, 2016; Rama et al., 2018). Estos tendrían efectos en las propiedades de respuesta neuronal a nivel de microcircuitos. A un nivel más global, la actividad sumada de múltiples axones que se proyectan, con velocidades de conducción variables a través de una red interconectada, podría dar lugar a un espectro de activaciones sincrónicas y/o asincrónicas (Mitra et al., 2015; Zeki, 2016). El reclutamiento diferencial de las poblaciones postsinápticas o las recombinaciones de la red podrían ser factores de las transiciones de estado o de la modulación.
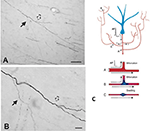
Figura 2. Un segmento de axón típicamente ramificado en la sustancia blanca (mono macaco). El segmento se origina en una neurona de la corteza parietal y se ve aquí en las proximidades de la corteza temporal ventral. El panel (A) es una ampliación inferior de (B). Obsérvese la doble bifurcación, en la que la primera rama hija (flecha sólida) es visiblemente más delgada (¿y no mielinizada?) que el axón principal. En la segunda bifurcación, ligeramente más distal (flecha hueca), las ramas hijas parecen tener el mismo diámetro, pero ambas son más delgadas que el axón principal. Barras de escala = 100 μm (A) y 10 μm (B). Reproducido de Zhong y Rockland (2003) con permiso. (C) Esquema de una neurona (azul) y su topología de ramificación extendida (escorzada para facilitar el formato). Un potencial de acción (PA) puede seguir caminos tortuosos (A-C) hacia múltiples objetivos. La fiabilidad de la propagación depende tanto de las propiedades eléctricas activas del axón como de su geometría, incluidas las inhomogeneidades de la membrana, como las hinchazones y los diámetros de ramificación incompatibles. Abajo: esquema para ilustrar la propagación fiable (A, con una adaptación óptima de la impedancia entre las ramas madre e hija), y la propagación lenta o fallida (B, cuando la rama hija tiene un diámetro mayor; C, cuando hay una hinchazón de la membrana interpuesta). Reproducido de Huguenard (2000) con permiso.
La geometría del axón, las propiedades eléctricas activas y las inhomogeneidades de la membrana en los puntos de ramificación son bien conocidas como factores de propagación fiable (por ejemplo, Manor et al., 1991; Innocenti et al., 1994; Tettoni et al., 1998; Huguenard, 2000; Ofer et al., 2017). Esto conduce a varios escenarios diferentes sobre las características temporales consecuentes a la colateralización.
En primer lugar, puede haber una activación sincrónica a lo largo de las ramas hijas. Las vías auditivas del tronco encefálico se proyectan a través de un único axón bifurcado a objetivos ipsi y contralaterales (respectivamente, vías físicas cortas y largas). La transmisión isócrona se consigue mediante la mielinización diferencial y el calibre del axón de las dos ramas hijas (es decir, menor calibre y menor longitud intermodal ipsilateral; Seidl, 2014; Seidl y Rubel, 2016). Dado que la mayoría de los axones ramificados, en comparación con las vías auditivas del tronco encefálico, cubren un territorio más extenso y subsisten funciones menos definidas, los datos son en gran medida incompletos o faltan para otros sistemas. Sin embargo, se podría predecir, en el caso de la sincronía, que las ramas proximales (es decir, las colaterales intrínsecas de Meynert u otras células piramidales) tendrían especializaciones anatómicas que darían lugar a tiempos de conducción más largos, para compensar y coincidir con las distancias más largas de las colaterales extrínsecas. Como se ha señalado anteriormente, esta simple predicción no parece cumplirse. Una investigación más profunda implicará el muestreo de axones identificados a lo largo de grandes distancias, y no sería fácil de conseguir.
En segundo lugar, la activación específica de la rama puede ser asíncrona. Esto podría deberse a un fallo selectivo de la transmisión y/o a tiempos de conducción asíncronos a través de la rama del axón (Figura 2; Huguenard, 2000; Bucher, 2016). Los modelos de circuitos corticales describen estados de enrutamiento distintivos de sincronía transitoria de corta duración que podrían conformar dinámicamente el flujo de información (Palmigiano et al., 2017). Se carece en gran medida de datos experimentales comparables para los axones de larga distancia. La topología colateral de las proyecciones talamocorticales, sin embargo, proporciona un ejemplo evocador de un patrón de activación asíncrono complicado, dependiente de la actividad y/o del estado.
La actividad cortical y talamocortical es altamente dependiente del estado; y la interacción de las entradas extrínsecas presinápticas (¿específicas de la rama?) con la membrana intrínseca y las propiedades sinápticas de las neuronas postsinápticas se considera fundamental para la generación de la actividad rítmica (con «amplios efectos desde la potenciación o el bloqueo del procesamiento sensoriomotor….», McCormick et al, 2015).
La variabilidad en las respuestas corticales es paradójica ya que estas también sirven como sustratos de la experiencia sensorial estable. La variabilidad neuronal se ha asociado con el grado de sincronía heterogénea a través de la entrada extrínseca; es decir, se predice que la estimulación sensorial o las condiciones conductuales que aumentan la homogeneidad de la entrada a un área determinada también reducen la variabilidad neuronal (Gomez-Laberge et al., 2016). En debates recientes sobre las respuestas de los microcircuitos se ha especulado sobre un papel destacado de las ligeras variaciones o diferencias de información: «¿Pero qué pasa si las diferencias entre la conectividad dentro de cohortes de células de la misma clase son importantes para la función del circuito?» (Morgan y Lichtman, 2017).
Propiedades dinámicas de los axones
Se ha informado de cambios en la latencia de respuesta en relación con diferentes estados de alerta. En la vía corticotalámica, el aumento del estado de alerta se traduce en una latencia de respuesta significativamente menor. Esto y/o los cambios en la frecuencia de disparo de los impulsos que llegan pueden ser responsables de un aumento dramático de la fiabilidad de la respuesta para la subpoblación (58%) de las neuronas corticogeniculadas que responden visualmente (en conejos: Stoelzel et al., 2017). Estos resultados pertenecen a axones individuales fisiológicamente identificados; pero se puede especular sobre una aplicabilidad más amplia a ramas de axones colateralizados.
Se han demostrado procesos continuos de sinaptogénesis y recambio de axones distales en la corteza adulta (NHP: Stettler et al., 2006). En escalas de tiempo más cortas, la microscopía de superresolución del hipocampo CA3 no mielinizado y marcado con GFP en rodajas de cerebro organotípicas muestra que los axones se ensanchan gradualmente después de episodios de disparos de alta frecuencia, una observación confirmada por el registro electrofisiológico (Chereau et al., 2017). Es probable que se descubran otros cambios específicos de las ramas; por ejemplo, las arborizaciones terminales de los axones etiquetados individualmente del rafe dorsal tienen un porcentaje específico de boutones que contienen la proteína VGLUT3 (un porcentaje mayor para las ramas que terminan en el estriado que en la corteza motora). Esto implica un mecanismo de tráfico complejo y no uniforme a través de las colaterales (Gagnon y Parent, 2014).
Conclusión
En este artículo de Perspectiva, he discutido la ramificación de los axones como algo relevante para los cambios en el estado del cerebro, con un impacto efectuado a través de las propiedades específicas de las ramas, el reclutamiento diferencial de conjuntos postsinápticos y los patrones de sincronización de todo el cerebro. Esto se basa en discusiones de larga duración sobre las topologías de las ramificaciones axónicas y cómo éstas podrían modular el procesamiento de la información mediante retrasos en la propagación de los impulsos, el filtrado diferencial de las ramificaciones y la excitabilidad dependiente de la actividad (por ejemplo, Segev y Schneidman, 1999). Con sólo unas pocas excepciones, como la vía auditiva del tronco cerebral, todavía se carece en gran medida de datos sólidos sobre las activaciones sincrónicas y asincrónicas a través de las ramas hijas y cómo estas relaciones temporales podrían impactar en la capacidad de respuesta neuronal postsináptica (pero, véase Gómez-Laberge et al., 2016; Stoelzel et al., 2017). Por lo tanto, un desafío continuo es dilucidar las características específicas de las ramas dentro de los axones individuales y los efectos en los conjuntos postsinápticos. Los trabajos recientes traen a la palestra preguntas adicionales sobre la heterogeneidad de la red, incluyendo por qué las neuronas de una sola área de origen se proyectan de manera variable a uno o más objetivos en lo que se describe repetidamente como «en todas las combinaciones».
Contribuciones del autor
El autor confirma ser el único contribuyente de este trabajo y lo aprobó para su publicación.
Financiación
Agradecemos a los Institutos Nacionales de Salud (NIH) por el apoyo financiero: MH107456.
Declaración de conflicto de intereses
El autor declara que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.
Barry, J. M. (2015). Actividad axonal in vivo: consideraciones técnicas e implicaciones para la exploración de circuitos neuronales en animales en movimiento libre. Front. Neurosci. 9:153 doi: 10.3389/fnins.2015.00153
PubMed Abstract | CrossRef Full Text | Google Scholar
Gagnon, D., and Parent, M. (2014). Distribution og VGLUT3 in highly collateralized axons from the rat dorsal raphe nucleus as revealed by single-neuron reconstructions. PLoS ONE 9:e87709. doi: 10.1371/journal.pone.0087709
CrossRef Full Text | Google Scholar
Kita, T., and Kita, H. (2012). El núcleo subtalámico es uno de los múltiples sitios de inervación para los axones corticofugales de largo alcance: un estudio de trazado de axón único en la rata. J. Neurosci. 32, 5990-5999 doi: 10.1523/JNEUROSCI.5717-11
PubMed Abstract | CrossRef Full Text | Google Scholar