Frontiers in Systems Neuroscience
Les changements d’état cérébral sont associés à des changements de microcircuit dans les propriétés de tir neuronal et à des changements de macro-niveau dans les modèles synchrones ou asynchrones d’activation cérébrale. Dans ce cadre, les axones ont été relativement moins étudiés (Barry, 2015), et alors principalement dans le contexte de la vitesse de conduction des potentiels d’action et de l’augmentation de la vigilance qui peut résulter de changements dans la vitesse de conduction (par exemple, Stoelzel et al., 2017). En outre, la topologie très ramifiée de nombreux axones semble bien conçue pour recruter de manière différentielle des groupes de neurones postsynaptiques distribués, éventuellement de manière dépendante de l’état. Le traitement du signal peut s’effectuer dans au moins trois domaines axonaux, à savoir la cartographie, l’amplification et la synchronisation (Innocenti et al., 2016 ; Innocenti, 2017). Dans cette perspective, j’aborde d’abord brièvement des exemples de réseaux de collatéralisation axonale, puis certaines des caractéristiques intrinsèques de l’axone qui pourraient sous-tendre le recrutement postsynaptique différentiel. En l’absence de paramètres ou de mécanismes détaillés, l’objectif est principalement de mettre en évidence des caractéristiques générales qui pourraient figurer dans le contrôle et les transitions des états cérébraux.
- Collatérales d’axones
- Collatéralisation non stéréotypée
- Collatérales intrinsèques
- Un exemple intéressant : Les cellules de Meynert dans l’aire V1 des primates non humains
- Signification fonctionnelle de la ramification des axones
- Propriétés dynamiques des axones
- Conclusion
- Contributions de l’auteur
- Financement
- Déclaration de conflit d’intérêts
Collatérales d’axones
Tous les axones ont une arborisation distale élaborée dans la structure cible. De nombreux axones ont en outre de multiples branches (alias collatérales) qui ciblent des structures distinctes (examinées dans Rockland, 2013, 2018). La ramification des axones des neurones corticothalamiques de la couche 5 en est un excellent exemple. Cela a été documenté à plusieurs reprises et est souvent discuté comme un mécanisme clé par lequel un organisme peut distinguer si les changements dans l’entrée sensorielle sont produits par des changements dans l’environnement ou par des mouvements auto-initiés (« copie d’efférence » ou « décharge collatérale », Guillery et Sherman, 2011).
Chez les rongeurs, où il existe un grand nombre de techniques applicables pour étudier cette question, la collatéralisation est connue pour être relativement commune. Pour donner plusieurs exemples : (1) les neurones du subiculum hippocampique projettent vers les corps mammillaires, le cortex rétrosplénial, ou par des collatérales vers les deux (rat : Kinnavane et al, 2018) ; (2) les neurones sérotoninergiques du noyau du raphé dorsal (DR) contactent selon diverses combinaisons le striatum, le cortex préfrontal et l’amygdale (rat : Gagnon et Parent, 2014) ainsi que des combinaisons de noyaux autonomes (Waselus et al., 2011). Dans ce cas, l’activation de la réponse au stress par les collatérales de la RD pourrait aboutir à une activation synchronisée des noyaux associés à la libération de neurohormones ou aux réponses pressives. Les activations différentielles et coordonnées des structures du cerveau antérieur pourraient contribuer aux fonctions multiformes mais connexes de la RD, comme la régulation du cycle veille-sommeil, la modulation des signaux de douleur ou l’expression de l’humeur (Gagnon et Parent, 2014).
Troisièmement, les études anatomiques des projections thalamocorticales de la souris identifient des » axones multispécifiques » qui se ramifient largement vers des domaines restreints dans des zones corticales (et sous-corticales) distinctes. On a émis l’hypothèse que ceux-ci orchestrent l’émergence et la reconfiguration rapides d’assemblées neuronales spatialement distribuées et synchronisables (Clasca et al., 2016).
Quatrièmement, une étude récente des connexions corticocorticales utilisant le traçage axonal du cerveau entier dans le cortex visuel de la souris a révélé que 23 des 30 neurones contactaient de deux à sept autres aires corticales. Pour confirmer ce résultat, le séquençage à haut débit de l’ADN de neurones génétiquement codés par code-barres a révélé que 44 % des 533 neurones présentaient des projections multiples ( » broadcast neurons « , Han et al., 2018). Han et al. ont provisoirement distingué deux grands types de neurones de projection, une sous-population plus petite « dédiée » (uni-target), coexistant avec une prévalence de cellules de « diffusion » (projection multiple). Cette architecture pourrait-elle servir à moduler l’état cognitif et le traitement sensoriel ?
Collatéralisation non stéréotypée
Comme on l’a remarqué plus haut, les neurones qui collatéralisent le font selon un modèle non stéréotypé. Au sein d’une projection désignée (définie par l’origine), les neurones envoient des branches vers un sous-ensemble diversifié de zones cibles (« dans toutes les combinaisons »). Cette observation est si cohérente qu’elle peut être considérée comme une règle, bien que les paramètres détaillés n’aient pas été tabulés. La signification fonctionnelle n’est pas claire non plus, mais des résultats émergents suggèrent que les entrées hétérogènes et variables d’un neurone cortical (et, par extension, nous pourrions en déduire des assemblages neuronaux) sont importantes pour conduire la variabilité et les changements de train de pointes à travers les essais expérimentaux (Gomez-Laberge et al, 2016 et voir ci-dessous).
Collatérales intrinsèques
Dans toutes les espèces, les neurones de projection corticale à longue distance, en plus de cibles extrinsèques uniques ou multiples, ont généralement une arborisation intrinsèque élaborée. Certains neurones corticaux ont seulement une collatéralisation intrinsèque (locale), et d’autres seulement une extrinsèque (rat : Kita et Kita, 2012). Bien qu’il n’existe que peu de données sur les proportions réelles d’arborisations intrinsèques et extrinsèques (Parent et al., 2000 ; Rockland, 2018), les preuves suggèrent que cela sera très variable. Même au sein du système de connexions intrinsèques, non seulement il existe des différences dans le nombre de collatérales et le nombre de boutons synaptiques, mais un seul neurone peut avoir un mélange de collatérales myélinisées et non myélinisées (cortex visuel du chat : Martin et al., 2014 ; Koestinger et al., 2017). La myélinisation spécifique à une branche pourrait entraîner une augmentation de la vitesse de conduction spécifique à la branche, bien que Koestinger et al. suggèrent que cela pourrait avoir plus à voir avec des facteurs tels que la sécurité accrue de la transmission, vraisemblablement, encore une fois, spécifique à la branche.
Une observation curieuse liée à la myélinisation concerne la strie de Gennari, la bande myélinisée d’axones dans la couche 4B de l’aire V1 des primates. Comme cette bande est constituée de collatéraux intrinsèques, l’explication courante, selon laquelle la myélinisation est un moyen d’augmenter la vitesse de conduction sur de longues distances, n’est pas immédiatement applicable. Les collatérales locales n’ont pas besoin ( ?) d’être augmentées par rapport à des cibles éloignées et, en fait, pour la synchronisation que l’on aurait pu prévoir, l’augmentation de la conduction locale (via la myélinisation ?) semble paradoxale. Se pourrait-il que la myélinisation soit liée à d’autres facteurs, tels que des modifications du diamètre des axones liées à la plasticité (ou à l’état) ?
Un exemple intéressant : Les cellules de Meynert dans l’aire V1 des primates non humains
Ces grands neurones, à la frontière des couches 5 et 6, se projettent de façon variable vers l’aire extrastriée MT, et/ou d’autres aires d’association visuelle, et/ou vers le noyau pulvinaire, et/ou vers le colliculus supérieur et le pretectum (Weisenhorn et al., 1995 ; Rockland et Knutson, 2001). La collatéralisation intrinsèque est exceptionnellement étendue, mesurée à 8,0 mm du soma, sur la base de reconstructions subtotales, et comportant au moins 800-1 370 boutons (Figure 1). Dans l’arborisation axonale, il semble y avoir une variabilité distincte dans le diamètre des branches ; c’est-à-dire que les branches extrinsèques dirigées vers la zone MT sont grandes (diamètre ~3,0 μm), mais les branches intrinsèques et celles qui se projettent vers le pulvinar et le colliculus supérieur semblent plus petites, comme en témoigne la microscopie optique (cf. figure 1B (intrinsèque) et figure 1D (extrinsèque à la zone MT). Les diamètres variables indiquent vraisemblablement des différences dans le degré de myélinisation et, par déduction, dans la vitesse de conduction.
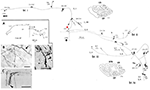
Figure 1. Arborisation axonale proximale typique, spatialement étendue, d’une cellule de Meynert (astérisque rouge) dans le cortex visuel primaire d’un singe macaque. Il existe trois collatérales intrinsèques majeures (appelées br. i, ii, iv), qui s’étendent sur 3,0 mm en position dorsale dans la couche 1, sur 3,0 mm en position ventrale dans la couche 6, sur 4,0 mm en position ventrale dans la couche 6 et sur 0,5 mm dans la couche 4B, comme l’indiquent les pointes de flèche dans les deux coupes coronales (sections 222 et 274, où la position dorsale est à gauche). Au total, les collatérales intrinsèques s’étendent sur 5,9 mm d’avant en arrière (117 sections × 50 μm). Une autre collatérale extrinsèque (br. iii) se trouve dans les couches 4 et 6 de la zone V2. Des portions des collatérales individuelles et de l’axone principal (flèche épaisse) n’ont pas pu être suivies, comme l’indiquent les lignes pointillées. L’encart à faible grossissement (A, à gauche) donne un aperçu schématique de la configuration générale. Les chiffres indiquent les sections individuelles, où 20 chiffres = 1,0 mm. Toutes les branches possèdent de nombreux petits groupes synaptiques, dont l’un est illustré en (B). Notez la diminution du diamètre entre l’axone principal (flèche) et l’arborisation terminale. Les axones extrinsèques (C) sont de diamètres variables (un axone de grand diamètre en tête de flèche). (D) Les terminaisons extrinsèques dans la zone MT comprennent quelques axones de grand diamètre. Barre d’échelle = 25 μm dans (B), 100 μm dans (C), 20μm dans (D). CF, fissure calcarine ; LS, sillon lunaire ; STS, sillon temporal supérieur ; L, couche. Modifié à partir des figures 1, 9 de Rockland et Knutson (2001) et des figures 6f, 7b de Rockland (1995) avec permission.
Signification fonctionnelle de la ramification des axones
Une composante importante de la collatéralisation est que les branches filles ne sont souvent pas uniformes, mais surtout aux points de ramification, varient en diamètre (figure 2). La variabilité du diamètre ainsi que d’autres paramètres auront un impact sur l’excitabilité, la vitesse de conduction et d’autres aspects de la propagation du signal. Parmi les autres paramètres ayant un impact, citons la largeur de la myéline et la longueur intermodale, ainsi que la densité et la distribution des canaux ioniques (examinés dans Debanne et al., 2011 ; Seidl, 2014 ; Bucher, 2016 ; Seidl et Rubel, 2016 ; Rama et al., 2018). Ceux-ci auraient des effets sur les propriétés de la réponse neuronale au niveau du microcircuit. Au niveau plus global, l’activité additionnée de plusieurs axones en projection, avec des vitesses de conduction variables à travers un réseau interconnecté, pourrait entraîner un spectre d’activations synchrones et/ou asynchrones (Mitra et al., 2015 ; Zeki, 2016). Le recrutement différentiel des populations postsynaptiques ou les recombinaisons du réseau pourraient être des facteurs de transitions d’état ou de modulation.
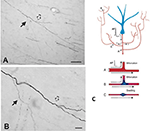
Figure 2. Un segment d’axone typiquement ramifié dans la substance blanche (singe macaque). Le segment provient d’un neurone du cortex pariétal et est vu ici à proximité du cortex temporal ventral. Le panneau (A) est un grossissement inférieur de (B). Notez les doubles bifurcations, où la première branche fille (flèche pleine) est manifestement plus fine (et non myélinisée ?) que l’axone principal. Dans la seconde bifurcation, légèrement plus distale (flèche creuse), les branches filles semblent de diamètre à peu près égal, mais toutes deux sont plus fines que l’axone principal. Barres d’échelle = 100 μm (A) et 10 μm (B). Reproduit de Zhong et Rockland (2003) avec autorisation. (C) Schéma d’un neurone (bleu) et de sa topologie de ramification étendue (raccourci pour des raisons de formatage pratique). Un potentiel d’action (PA) peut suivre des chemins détournés (A-C) vers plusieurs cibles. La fiabilité de la propagation dépend à la fois des propriétés électriques actives de l’axone et de sa géométrie, notamment des inhomogénéités membranaires telles que les renflements et les diamètres incompatibles des branches. Ci-dessous : schéma illustrant une propagation fiable (A, avec une adaptation optimale de l’impédance entre la branche mère et la branche fille), et une propagation ralentie ou ratée (B, où la branche fille a un diamètre élargi ; C, où il y a un gonflement membranaire interposé). Reproduit de Huguenard (2000) avec autorisation.
La géométrie de l’axone, les propriétés électriques actives et les inhomogénéités membranaires aux points de ramification sont bien connues comme facteurs de propagation fiable (par exemple, Manor et al., 1991 ; Innocenti et al., 1994 ; Tettoni et al., 1998 ; Huguenard, 2000 ; Ofer et al., 2017). Cela conduit à plusieurs scénarios différents sur les caractéristiques temporelles consécutives à la collatéralisation.
Premièrement, il peut y avoir une activation synchrone tout au long des branches filles. Les voies auditives du tronc cérébral projettent via un seul axone bifurquant vers des cibles ipsi- et contralatérales (respectivement, voies physiques courtes et longues). La transmission isochrone est assurée par une myélinisation et un calibre d’axone différentiels des deux branches filles (c’est-à-dire un calibre plus petit et des longueurs intermodales plus courtes au niveau ipsilatéral ; Seidl, 2014 ; Seidl et Rubel, 2016). Étant donné que la plupart des axones ramifiés, en comparaison avec les voies auditives du tronc cérébral, couvrent un territoire plus vaste et subsument des fonctions moins bien définies, les données sont largement incomplètes ou manquantes pour les autres systèmes. On pourrait cependant prédire, dans le cas de la synchronicité, que les branches proximales (c’est-à-dire les collatérales intrinsèques des cellules pyramidales de Meynert ou d’autres cellules pyramidales) auraient des spécialisations anatomiques entraînant des temps de conduction plus longs, pour compenser et correspondre aux distances plus longues des collatérales extrinsèques. Comme indiqué ci-dessus, cette prédiction simple ne semble pas se vérifier. Une étude plus approfondie impliquera un échantillonnage à partir d’axones identifiés sur de longues distances, et ne serait pas facile à réaliser.
Deuxièmement, l’activation spécifique à une branche peut être asynchrone. Cela pourrait être dû à un échec sélectif de la transmission et/ou à des temps de conduction asynchrones à travers la tige axonique (figure 2 ; Huguenard, 2000 ; Bucher, 2016). Les modèles de circuits corticaux décrivent des états de routage distincts de synchronie transitoire de courte durée qui pourraient façonner dynamiquement le flux d’informations (Palmigiano et al., 2017). Des données expérimentales comparables font largement défaut pour les axones à longue distance. La topologie collatérale des projections thalamocorticales, cependant, fournit un exemple évocateur d’un modèle d’activation asynchrone compliqué, dépendant de l’activité et/ou de l’état.
L’activité corticale et thalamocorticale est hautement dépendante de l’état ; et l’interaction des entrées extrinsèques présynaptiques (spécifiques à la branche ?) avec les propriétés membranaires et synaptiques intrinsèques des neurones postsynaptiques est considérée comme fondamentale pour la génération de l’activité rythmique (avec « des effets très variés allant de l’amélioration ou du blocage du traitement sensori-moteur…., » McCormick et al, 2015).
La variabilité des réponses corticales est paradoxale puisque celles-ci servent également de substrats à une expérience sensorielle stable. La variabilité neuronale a été associée au degré de synchronie hétérogène à travers l’entrée extrinsèque ; c’est-à-dire que la stimulation sensorielle ou les conditions comportementales qui augmentent l’homogénéité de l’entrée dans une zone donnée est prédite pour réduire également la variabilité neuronale (Gomez-Laberge et al., 2016). Des discussions récentes sur les réponses des microcircuits ont spéculé sur un rôle prépondérant des légères variances ou des différences d’information : « Mais si les différences entre la connectivité au sein des cohortes de cellules de la même classe sont importantes pour la fonction du circuit ? ». (Morgan et Lichtman, 2017).
Propriétés dynamiques des axones
Des changements dans la latence de réponse ont été rapportés en relation avec différents états de vigilance. Dans la voie corticothalamique, l’augmentation de la vigilance entraîne une réduction significative de la latence de réponse. Ceci et/ou des changements dans la fréquence de tir des impulsions qui arrivent peuvent être responsables d’une fiabilité de réponse considérablement accrue pour la sous-population (58%) de neurones corticogéniques visuellement sensibles (chez le lapin : Stoelzel et al., 2017). Ces résultats concernent des axones uniques physiologiquement identifiés ; mais on peut spéculer sur une applicabilité plus large aux branches des axones collatéralisés.
Des processus continus de synaptogenèse et de renouvellement des axones distaux ont été démontrés dans le cortex adulte (NHP : Stettler et al., 2006). À des échelles de temps plus courtes, la microscopie à superrésolution d’hippocampes CA3 non myélinisés marqués par la GFP dans des tranches de cerveau organotypiques montre que les axones s’élargissent progressivement après des épisodes de tir à haute fréquence, une observation confirmée par des enregistrements électrophysiologiques (Chereau et al., 2017). D’autres changements spécifiques aux branches sont susceptibles d’être découverts ; par exemple, les arborisations terminales d’axones marqués individuellement provenant du raphé dorsal présentent un pourcentage spécifique de boutons contenant la protéine VGLUT3 (pourcentage plus élevé pour les branches se terminant dans le striatum que dans le cortex moteur). Cela implique un mécanisme de trafic complexe et non uniforme à travers les collatéraux (Gagnon et Parent, 2014).
Conclusion
Dans cet article de Perspective, j’ai discuté de la ramification des axones comme étant pertinente pour les changements d’état du cerveau, avec un impact effectué via les propriétés spécifiques des branches, le recrutement différentiel des ensembles postsynaptiques et les modèles de synchronisation du cerveau entier. Ces travaux s’appuient sur des discussions de longue date concernant les topologies des ramifications axonales et la façon dont elles pourraient moduler le traitement de l’information par des délais dans la propagation des impulsions, un filtrage différentiel spécifique à la ramification et une excitabilité dépendant de l’activité (par exemple, Segev et Schneidman, 1999). À quelques exceptions près, comme dans le cas de la voie auditive du tronc cérébral, on manque encore largement de données concrètes sur les activations synchrones et asynchrones à travers les branches filles et sur la façon dont ces relations temporelles pourraient avoir un impact sur la réactivité neuronale postsynaptique (mais, voir Gomez-Laberge et al., 2016 ; Stoelzel et al., 2017). Ainsi, un défi permanent consiste à élucider les caractéristiques spécifiques des branches au sein des axones individuels et leurs effets sur les ensembles postsynaptiques. Des travaux récents mettent en avant des questions supplémentaires sur l’hétérogénéité des réseaux, notamment pourquoi les neurones d’une même zone source se projettent de manière variable vers une ou plusieurs cibles dans ce qui est décrit à plusieurs reprises comme « dans toutes les combinaisons ».
Contributions de l’auteur
L’auteur confirme être le seul contributeur de ce travail et l’a approuvé pour la publication.
Financement
Nous remercions les National Institutes of Health (NIH) pour leur soutien financier : MH107456.
Déclaration de conflit d’intérêts
L’auteur déclare que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Barry, J. M. (2015). Activité axonale in vivo : considérations techniques et implications pour l’exploration des circuits neuronaux chez les animaux se déplaçant librement. Front. Neurosci. 9:153 doi : 10.3389/fnins.2015.00153
PubMed Abstract | CrossRef Full Text | Google Scholar
Gagnon, D., et Parent, M. (2014). Distribution og VGLUT3 dans les axones hautement collatéralisés du noyau du raphé dorsal du rat, comme révélé par des reconstructions d’un seul neurone. PLoS ONE 9:e87709. doi : 10.1371/journal.pone.0087709
CrossRef Full Text | Google Scholar
Kita, T., et Kita, H. (2012). Le noyau subthalamique est l’un des multiples sites d’innervation des axones corticofuges à longue portée : une étude de traçage d’axone unique chez le rat. J. Neurosci. 32, 5990-5999 doi : 10.1523/JNEUROSCI.5717-11
PubMed Abstract | CrossRef Full Text | Google Scholar
.