Frontiers in Systems Neuroscience
Změny stavu mozku jsou spojeny se změnami mikroobvodů ve vlastnostech vypalování neuronů a se změnami na makroúrovni v synchronních nebo asynchronních vzorcích aktivace mozku. V tomto rámci byly axony zkoumány relativně méně (Barry, 2015), a to především v souvislosti s rychlostí vedení akčních potenciálů a zvýšenou bdělostí, která může být důsledkem změn rychlosti vedení (např. Stoelzel et al., 2017). Kromě toho se však zdá, že vysoce rozvětvená topologie mnoha axonů je dobře navržena tak, aby diferencovaně rekrutovala distribuované postsynaptické skupiny neuronů, možná v závislosti na stavu. Zpracování signálu může probíhat přinejmenším ve třech axonálních oblastech; konkrétně v mapování, zesílení a časování (Innocenti et al., 2016; Innocenti, 2017). V této Perspektivě nejprve stručně pojednám o síťových příkladech kolateralizace axonů a poté o některých vnitřních vlastnostech axonů, které by mohly být základem rozdílného postsynaptického náboru. Chybí podrobné parametry nebo mechanismy, cílem je především zdůraznit obecné rysy, které by mohly figurovat v řízení a přechodech mozkových stavů.
Kolateralizace axonů
Všechny axony mají v cílové struktuře propracovanou distální arborizaci. Mnoho axonů má navíc více větví (tzv. kolaterál), které cílí na výrazně odlišné struktury (přehled v Rockland, 2013, 2018). Ukázkovým příkladem je větvení axonů z kortikotalamických neuronů 5. vrstvy. Toto bylo opakovaně zdokumentováno a často se o něm hovoří jako o klíčovém mechanismu, díky němuž může organismus rozlišit, zda jsou změny senzorických vstupů vyvolány změnami v prostředí, nebo pohyby, které sám inicioval („kopírování efference“ nebo „kolaterální výboj“, Guillery a Sherman, 2011).
U hlodavců, kde existuje velké množství použitelných technik pro zkoumání této problematiky, je kolateralizace známa jako poměrně běžná. Uveďme několik příkladů: (1) neurony v hipokampálním subikulu se promítají do mamilárních tělísek, retrospleniální kůry nebo pomocí kolaterál do obou (potkan: Kinnavane et al., 2018); (2) serotonergní neurony v dorzálním rafe (DR) jádru kontaktují v různých kombinacích striatum, prefrontální kůru a amygdalu (potkan: Gagnon a Parent, 2014), stejně jako kombinace autonomních jader (Waselus et al., 2011). V tomto případě by aktivace stresové reakce kolaterálami DR mohla dosáhnout synchronizované aktivace jader spojených s uvolňováním neurohormonů nebo tlakových reakcí. Diferencovaná, koordinovaná aktivace struktur předního mozku může přispívat k mnohostranným, ale souvisejícím funkcím DR, jako je regulace cyklu spánek-bdění, modulace signálů bolesti nebo exprese nálady (Gagnon a Parent, 2014).
Zatřetí, anatomické studie myších thalamokortikálních projekcí identifikují „multispecifické axony“, které se široce větví do omezených oblastí v samostatných kortikálních (a subkortikálních) oblastech. U nich se předpokládá, že organizují rychlý vznik a rekonfiguraci prostorově distribuovaných, synchronizovatelných neuronálních sestav (Clasca et al., 2016).
Za čtvrté, nedávná studie kortikokortikálních spojení pomocí celomozkového axonálního trasování v myší zrakové kůře zjistila, že 23 z 30 neuronů kontaktuje dvě až sedm dalších korových oblastí. Jako potvrzení tohoto výsledku bylo při vysoce výkonném sekvenování DNA geneticky čárově kódovaných neuronů zjištěno, že 44 % z 533 neuronů má vícenásobnou projekci („broadcast neurons“, Han et al., 2018). Han et al. předběžně rozlišili dva široké typy promítajících neuronů, menší „specializovanou“ (uni-target) subpopulaci, která koexistuje s převahou „broadcast“ (multiply projecting) buněk. Mohla by tato architektura sloužit modulacím kognitivního stavu a smyslového zpracování?
Nestereotypní kolateralizace
Jak bylo uvedeno výše, neurony, které kolateralizují, tak činí nestereotypním způsobem. V rámci určené projekce (definované počátkem) neurony vysílají větve do diverzifikované podmnožiny cílových oblastí („ve všech kombinacích“). Toto pozorování je natolik konzistentní, že je lze považovat za pravidlo, ačkoli podrobné parametry nebyly tabelovány. Funkční význam je také nejasný, ale objevující se výsledky naznačují, že heterogenní a variabilní vstupy do kortikálního neuronu (a z toho bychom mohli usuzovat i na neuronální asembláže) jsou důležité pro řízení variability a změn spike train napříč experimentálními pokusy (Gomez-Laberge et al., 2016 a viz níže).
Vnitřní kolaterály
Ve všech druzích mají korové projekční neurony na dlouhé vzdálenosti kromě jednoho nebo více vnějších cílů obvykle propracovanou vnitřní arborizaci. Některé korové neurony mají pouze vnitřní (lokální) kolateralizaci a některé pouze vnější (krysí: Kita a Kita, 2012). Ačkoli jsou k dispozici pouze kusé údaje o skutečném poměru intrinsické a extrinsické arborizace (Parent et al., 2000; Rockland, 2018), důkazy naznačují, že tento poměr bude velmi variabilní. Dokonce i v rámci systému intrinsických spojení existují nejen rozdíly v počtu kolaterál a počtu synaptických boutonů, ale jeden neuron může mít směs myelinizovaných a nemyelinizovaných kolaterál (kočičí zraková kůra: Martin et al., 2014; Koestinger et al., 2017). Myelinizace specifická pro danou větev by mohla vést ke zvýšení rychlosti vedení specifické pro danou větev, i když Koestinger et al. naznačují, že to může souviset spíše s faktory, jako je zvýšená bezpečnost přenosu, pravděpodobně opět specifická pro danou větev.
Zajímavé pozorování související s myelinizací se týká Gennariho stria, myelinizovaného pásu axonů ve vrstvě 4B oblasti V1 primátů. Protože se skládá z vnitřních kolaterál, nelze bezprostředně použít běžné vysvětlení, že myelinizace je prostředkem ke zvýšení rychlosti vedení na velké vzdálenosti. Místní kolaterály nepotřebují (?) zvětšení ve vztahu ke vzdáleným cílům a ve skutečnosti se pro synchronicitu, kterou bychom mohli předpokládat, zdá být zvýšení místního vedení (prostřednictvím myelinizace?) paradoxní. Je možné, že myelinizace souvisí s jinými faktory, například se změnami průměru axonu souvisejícími s plasticitou (nebo stavem)?
Zajímavý příklad: Meynertovy buňky v oblasti V1 u primátů
Tyto velké neurony na hranici vrstev 5 a 6 promítají variabilně do extrastriatální oblasti MT a/nebo do jiných zrakových asociačních oblastí a/nebo do pulvinárního jádra a/nebo do horního koliculu a pretekta (Weisenhorn et al., 1995; Rockland a Knutson, 2001). Vnitřní kolateralizace je mimořádně rozsáhlá, na základě dílčích rekonstrukcí se měří 8,0 mm od sómu a má nejméně 800-1 370 boutonů (obr. 1). Napříč axonální arborizací se zdá, že existuje výrazná variabilita v průměru větví; to znamená, že extrinsické větve směřující do oblasti MT jsou velké (průměr ~3,0 μm), ale intrinsické větve a větve promítající se do pulvinaru a horního koliculu se zdají být menší, jak se soudí při světelné mikroskopii (srov. obr. 1B (intrinsické) a obr. 1D (extrinsické do oblasti MT). Různé průměry pravděpodobně ukazují na rozdíly ve stupni myelinizace, a tím i v rychlosti vedení.
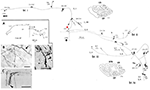
Obrázek 1. Typická, prostorově rozšířená proximální axonální arborizace Meynertovy buňky (červená hvězdička) v primární zrakové kůře opice makaka. Existují tři hlavní vnitřní kolaterály (označené jako br. i, ii, iv), které se táhnou 3,0 mm dorzálně ve vrstvě 1, 3,0 mm ventrálně ve vrstvě 6, 4,0 mm ventrálně ve vrstvě 6 a 0,5 mm ve vrstvě 4B, jak ukazují hroty šipek ve dvou nákresech koronálních řezů (řezy 222 a 274, kde dorzální je vlevo). Vnitřní kolaterály mají dohromady rozpětí 5,9 mm anteriorně-posteriorně (117 řezů × 50 μm). Další, vnější kolaterála (br. iii) se vyskytuje ve vrstvách 4 a 6 oblasti V2. Části jednotlivých kolaterál a hlavního axonu (tlustá šipka) nebylo možné sledovat, což je vyznačeno čárkovaně. Vložka s malým zvětšením (A, vlevo) poskytuje schematický přehled celkové konfigurace. Čísla označují jednotlivé řezy, kde 20 čísel = 1,0 mm. Všechny větve mají četné malé synaptické shluky, z nichž jeden je znázorněn v (B). Všimněte si zmenšeného průměru mezi hlavním axonem (šipka) a terminální arborizací. Vnější axony (C) mají různý průměr (jeden axon s velkým průměrem na hrotu šipky). (D) Extrinsická zakončení v oblasti MT zahrnují některé axony velkého průměru. Měřítko = 25 μm v (B), 100 μm v (C), 20 μm v (D). CF, calcarine fissure; LS, lunate sulcus; STS, superior temporal sulcus; L, layer. Upraveno podle obrázků 1, 9 v Rockland a Knutson (2001) a obrázků 6f, 7b z Rockland (1995) se svolením.
Funkční význam větvení axonů
Důležitou součástí kolateralizace je, že dceřiné větve často nejsou rovnoměrné, ale zejména v místech větvení mají různý průměr (obr. 2). Variabilita v průměru spolu s dalšími parametry ovlivní excitabilitu, rychlost vedení a další aspekty šíření signálu. Mezi další ovlivňující parametry patří šířka myelinu a intermodální délka a hustota a distribuce iontových kanálů (přehled v Debanne et al., 2011; Seidl, 2014; Bucher, 2016; Seidl a Rubel, 2016; Rama et al., 2018). Ty by měly vliv na vlastnosti nervové odpovědi na úrovni mikroobvodů. Na globálnější úrovni by součtová aktivita více promítajících se axonů s různou rychlostí vedení napříč propojenou sítí mohla vést ke spektru synchronních a/nebo asynchronních aktivací (Mitra et al., 2015; Zeki, 2016). Rozdílný nábor postsynaptických populací nebo rekombinace sítě by mohly být faktory přechodů mezi stavy nebo modulací.
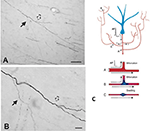
Obrázek 2. Typicky rozvětvený segment axonu v bílé hmotě (opice makak). Segment vychází z neuronu v parietální kůře a je zde vidět v blízkosti ventrální temporální kůry. Panel (A) je menší zvětšení panelu (B). Všimněte si dvojité bifurkace, kde první dceřiná větev (plná šipka) je nápadně tenčí (a nemyelinizovaná?) než hlavní axon. Ve druhém, o něco distálnějším rozdvojení (dutá šipka) se zdá, že dceřiné větve mají přibližně stejný průměr, ale obě jsou tenčí než hlavní axon. Měřítka = 100 μm (A) a 10 μm (B). Se svolením převzato z Zhong a Rockland (2003). (C) Schéma neuronu (modře) a topologie jeho rozšířeného větvení (z důvodu pohodlného formátování zkráceno). Akční potenciál (AP) může jít okružními cestami (A-C) k více cílům. Spolehlivost šíření závisí jak na aktivních elektrických vlastnostech axonu, tak na jeho geometrii, včetně nehomogenit membrány, jako jsou zduření a neslučitelné průměry větví. Níže: schéma pro ilustraci spolehlivého šíření (A, s optimální impedanční shodou mezi mateřskou a dceřinou větví) a zpomaleného nebo neúspěšného šíření (B, kde má dceřiná větev zvětšený průměr; C, kde je mezi nimi membránové zduření). Se svolením převzato z Huguenard (2000).
Geometrie axonu, aktivní elektrické vlastnosti a nehomogenity membrány v místech větvení jsou dobře známé jako faktory spolehlivého šíření (např. Manor et al., 1991; Innocenti et al., 1994; Tettoni et al., 1998; Huguenard, 2000; Ofer et al., 2017). To vede k několika různým scénářům o časových vlastnostech v důsledku kolateralizace.
Prvé může dojít k synchronní aktivaci v celé dceřiné větvi. Sluchové dráhy mozkového kmene se promítají prostřednictvím jediného bifurkačního axonu do ipsi- a kontralaterálních cílů (respektive krátkých a delších fyzických drah). Izochronního přenosu je dosaženo rozdílnou myelinizací a kalibrem axonů obou dceřiných větví (tj. menším kalibrem a kratší intermodální délkou ipsilaterálně; Seidl, 2014; Seidl a Rubel, 2016). Vzhledem k tomu, že většina rozvětvených axonů ve srovnání se sluchovými drahami mozkového kmene pokrývá větší území a zastává méně přesně definované funkce, jsou údaje pro jiné systémy z velké části neúplné nebo chybí. Dalo by se však předpokládat, že v případě synchronicity budou mít proximální větve (tj. vnitřní kolaterály Meynertových nebo jiných pyramidových buněk) anatomické specializace, které povedou k delším časům vedení, aby kompenzovaly a odpovídaly delším vzdálenostem vnějších kolaterál. Jak bylo uvedeno výše, zdá se, že tato jednoduchá předpověď neplatí. Další zkoumání bude vyžadovat odběr vzorků z identifikovaných axonů na velké vzdálenosti a nebylo by snadné ho dosáhnout.
Druhé, aktivace specifická pro danou větev může být asynchronní. To by mohlo být způsobeno selektivním selháním přenosu a/nebo asynchronními časy vedení napříč axonovým trsem (obr. 2; Huguenard, 2000; Bucher, 2016). Modely korových obvodů popisují výrazné směrové stavy krátkodobé přechodné synchronie, které by mohly dynamicky formovat tok informací (Palmigiano et al., 2017). Srovnatelná experimentální data pro axony na dlouhé vzdálenosti z velké části chybí. Kolaterální topologie talamokortikálních projekcí však poskytuje jeden příklad evokující komplikovaný, na aktivitě a/nebo stavu závislý asynchronní aktivační vzorec.
Kortikální a talamokortikální aktivita je vysoce závislá na stavu; a interakce presynaptických vnějších vstupů (specifických pro větev?) s vnitřními membránovými a synaptickými vlastnostmi postsynaptických neuronů se považuje za zásadní pro vznik rytmické aktivity (s „širokým rozsahem účinků od posílení nebo zablokování senzoricko-motorického zpracování….,“ McCormick et al., 2015).
Variabilita korových odpovědí je paradoxní, protože ty slouží také jako substráty stabilní smyslové zkušenosti. Neuronální variabilita souvisí s mírou heterogenní synchronizace napříč vnějšími vstupy; to znamená, že se předpokládá, že senzorická stimulace nebo behaviorální podmínky, které zvyšují homogenitu vstupů do dané oblasti, také snižují neuronální variabilitu (Gomez-Laberge et al., 2016). V nedávných diskusích o reakcích mikroobvodů se spekulovalo o významné úloze nepatrných variací nebo rozdílů v informacích: „Ale co když jsou pro funkci obvodu důležité rozdíly mezi konektivitou v rámci kohort buněk stejné třídy?“. (Morgan a Lichtman, 2017).
Dynamické vlastnosti axonů
Změny latence odezvy byly zaznamenány v souvislosti s různými stavy bdělosti. V kortikotalamické dráze vede zvýšená bdělost k výraznému zkrácení latence reakce. To a/nebo změny ve frekvenci vypalování přicházejících impulsů mohou být zodpovědné za dramaticky zvýšenou spolehlivost odpovědi u subpopulace (58 %) vizuálně reagujících kortikogenních neuronů (u králíků: Stoelzel et al., 2017). Tyto výsledky se týkají fyziologicky identifikovaných jednotlivých axonů; lze však spekulovat o širší aplikovatelnosti na větve kolateralizovaných axonů.
V dospělé kůře byly prokázány procesy synaptogeneze a distálního obratu axonů (NHP: Stettler et al., 2006). V kratším časovém měřítku superrozlišovací mikroskopie nemyelinizovaných hipokampů CA3 značených GFP v organotypových plátcích mozku ukazuje, že axony se po záchvatech vysokofrekvenčního pálení postupně rozšiřují, což je pozorování potvrzené elektrofyziologickým záznamem (Chereau et al., 2017). Pravděpodobně budou objeveny i další, větvově specifické změny; například terminální arborizace individuálně značených axonů z dorzálního rafu mají cílově specifické procento boutonů, které obsahují protein VGLUT3 (větší procento u větví končících ve striatu než v motorické kůře). To naznačuje komplexní, nejednotný mechanismus obchodu napříč kolaterálami (Gagnon a Parent, 2014).
Závěr
V tomto článku Perspektivy jsem se zabýval větvením axonů jako relevantním pro změny stavu mozku, přičemž dopad se projevuje prostřednictvím specifických vlastností větví, diferenciálního náboru postsynaptických souborů a vzorců synchronizace celého mozku. To navazuje na dlouhodobé diskuse týkající se topologií axonálního větvení a toho, jak by mohly modulovat zpracování informací pomocí časových zpoždění v šíření impulsů, diferenciální filtrace specifické pro jednotlivé větve a excitability závislé na aktivitě (např. Segev a Schneidman, 1999). Až na několik málo výjimek, jako je sluchová dráha mozkového kmene, stále z velké části chybí tvrdá data o synchronních a asynchronních aktivacích prostřednictvím dceřiných větví a o tom, jak by tyto časové vztahy mohly ovlivnit postsynaptickou reaktivitu neuronů (ale viz Gomez-Laberge et al., 2016; Stoelzel et al., 2017). Přetrvávajícím úkolem je tedy objasnit vlastnosti specifické pro jednotlivé větve v rámci jednotlivých axonů a jejich vliv na postsynaptické soubory. Nedávné práce přinášejí do popředí další otázky týkající se heterogenity sítě, včetně toho, proč se neurony z jedné zdrojové oblasti promítají variabilně do jednoho nebo více cílů v tom, co je opakovaně popisováno jako „ve všech kombinacích“.
Příspěvek autora
Autor potvrzuje, že je jediným autorem této práce a schválil ji k publikaci.
Financování
Děkujeme Národnímu ústavu zdraví (NIH) za finanční podporu: MH107456.
Prohlášení o střetu zájmů
Autor prohlašuje, že výzkum byl prováděn bez jakýchkoli komerčních nebo finančních vztahů, které by mohly být chápány jako potenciální střet zájmů.
Barry, J. M. (2015). Axonální aktivita in vivo: technické úvahy a důsledky pro zkoumání nervových obvodů u volně se pohybujících zvířat. Front. Neurosci. 9:153 doi: 10.3389/fnins.2015.00153
PubMed Abstract | CrossRef Full Text | Google Scholar
Gagnon, D. a Parent, M. (2014). Distribution og VGLUT3 in highly collateralized axons from the rat dorsal raphe nucleus as revealed by single-neuron reconstructions. PLoS ONE 9:e87709. doi: 10.1371/journal.pone.0087709
CrossRef Full Text | Google Scholar
Kita, T., and Kita, H. (2012). Subthalamické jádro je jedním z více inervačních míst pro kortikofugální axony dlouhého dosahu: studie sledování jednoho axonu u potkana. J. Neurosci. 32, 5990-5999 doi: 10.1523/JNEUROSCI.5717-11
PubMed Abstract | CrossRef Full Text | Google Scholar
.