Akut légzési szindróma (ARDS)
Original Editors – Students from Glasgow Caledonian University’s Cardiorespiratory Therapeutics Project.
Főmunkatársak – Geoff Boudreau, Matt Ross, Lucinda hampton, Kim Jackson és Adam Vallely Farrell
- Meghatározás
- Etiológia
- Epidemiológia
- Patológiai folyamat
- Klinikai megjelenés és értékelés
- Diagnosztikai eljárások
- Kórelőzmény
- Fizikai vizsgálat
- Vizsgálati eredmények
- Kezelés / beavatkozások
- Az ARDS lehetséges beavatkozásai
- Ventilátoros hiperinfláció (VHI)
- Fekvő helyzetbe helyezés
- Mechanikus lélegeztetés
- Inverse Ratio Ventilation (IRV)
- Légúti nyomáskioldó ventilláció (APRV)
- Nagyfrekvenciás oszcilláció (HFO)
- Extrakorporális membránoxigenizáció (ECMO)
- Inhalált nitrogén-monoxid
- A fizioterapeuta szerepe
- Következtetések
- Források
Meghatározás
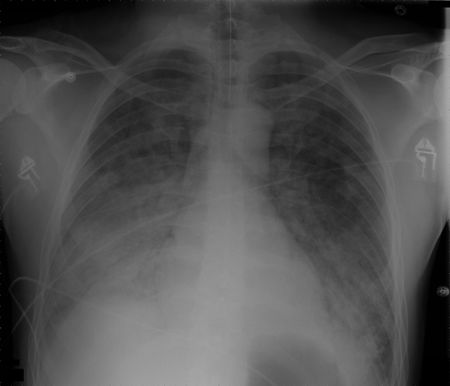
Az akut légzési distressz szindróma (ARDS)
- A súlyosan beteg betegek életveszélyes állapota, amelyet a rossz oxigenizáció, a tüdőinfiltráció és az akut kezdet jellemez.
- Mikroszkópos szinten a rendellenesség kapilláris endotélsérüléssel és diffúz alveoláris károsodással jár.
- Magas mortalitással jár, és kevés hatékony terápiás mód létezik az állapot leküzdésére.
- Az ARDS kialakulása után a betegeknél általában különböző mértékű tüdőartériás érszűkület alakul ki, és ezt követően pulmonális hipertónia alakulhat ki.
ARDS definíciója
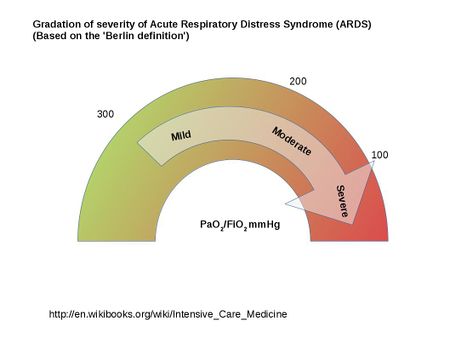
- Akut betegség, amely a kiváltó eseményt követő 7 napon belül kezdődik, és amelyet kétoldali tüdőinfiltráció és súlyos progresszív hipoxémia jellemez, a kardiogén tüdőödéma minden jelének hiányában.
- A beteg artériás vérében lévő oxigén (PaO2) és a belélegzett levegőben lévő oxigén hányadosa (FiO2) által meghatározott. Ezeknél a betegeknél a PaO2/FiO2 arány kisebb, mint 300. Az ARDS definícióját 2012-ben frissítették, és berlini definíciónak nevezik.

Etiológia
Az ARDS-nek számos kockázati tényezője van.
- Tüdőfertőzés pl. az ARDS előfordulási aránya COVID-19 fertőzéssel 17% és 41% között változik
- Tüdőaspiráció
- Tüdőn kívüli források közé tartozik a szepszis, trauma, masszív transzfúzió, fulladás, gyógyszer-túladagolás, zsírembólia, toxikus füstök belélegzése és pancreatitis (ezek a mellkason kívüli betegségek és/vagy sérülések gyulladásos kaszkádot váltanak ki, amely a tüdőkárosodásban csúcsosodik ki).
Az ARDS néhány kockázati tényezője a következő:
- Előrehaladott életkor
- Női nem
- Dohányzás
- Alkoholfogyasztás
- Aorta-érműtét
- Kardiovaszkuláris
- . sebészet
- Traumás agysérülés
Epidemiológia
- Az ARDS előfordulásának becslései az Egyesült Államokban 64.2 és 78,9 eset/100 000 személyév között mozog.
- Az ARDS-esetek 25 százaléka kezdetben enyhe (1/3-uk súlyos vagy közepesen súlyosra fejlődik), 75 százaléka pedig közepesen súlyosnak vagy súlyosnak minősül.
- A szakirodalmi áttekintés az 1994 és 2006 közötti időszakban a halálozás évi 1,1%-os csökkenését mutatta ki.
- Az ARDS halálozása a betegség súlyosságától függ, enyhe, közepes és súlyos betegség esetén 27%, 32%, illetve 45%.
- Az ARDS-ben szenvedők előfordulási gyakorisága nagyban különbözik a földrajzi területek között. Bár a különbségek oka nem tisztázott, egyes feltételezések szerint ez az egészségügyi ellátórendszerek különbségeiből eredhet. A beteg megfelelő nyilvántartásához és kezeléséhez szükség van a diagnózis felállításának és a másodlagos állapot megkülönböztetésének képességére.
Patológiai folyamat
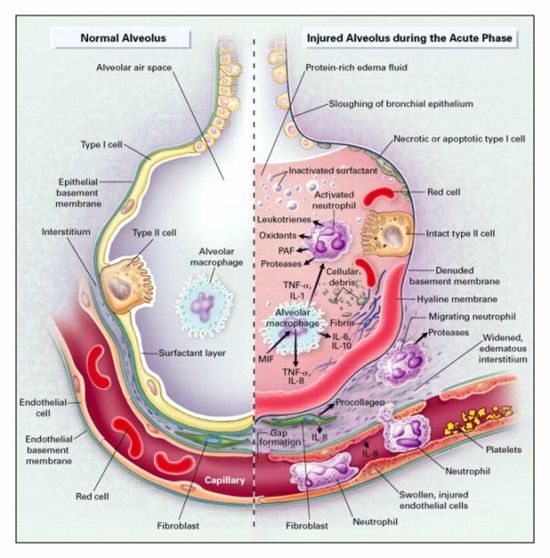
Az ARDS különböző etiológiájú sztereotip választ jelent.
Egymás fázisokon keresztül halad
- Első fázis – Az alveolo-kapilláris gát károsodása, amely tüdőödémához vezet. A tüdőhám és az endothelsejtek károsodását gyulladás, apoptózis, nekrózis és fokozott alveolakapilláris-permeabilitás jellemzi, ami alveoláris ödéma és proteinózis kialakulásához vezet. A folyadékok és fehérjék kétirányú szivárgása az alveolusba, valamint a szurfaktáns fehérjék és az alveoláris citokinek a plazmába. A hámgát megszakad a 2-es típusú alveoláris sejtek proliferációjával, ami a surfactant diszfunkciójához vezet.Az alveoláris ödéma viszont csökkenti a gázcserét, ami hipoxémiához vezet.
- Proliferatív fázis – javuló tüdőfunkció és gyógyulás jellemzi
- Végső fibrotikus fázis – az akut betegségfolyamat végét jelzi. A surfactant turnover jelentősen megnövekszik, és a hámot bélelő folyadék is kiemeli a fibrosing alveolitist a tüdőkárosodás korai szakaszában.
- Az ARDS-ben megfigyelhető károsodási mintázat jellemzője, hogy nem egységes. A tüdő egyes szegmensei súlyosabban károsodhatnak, ami a tüdő regionális compliance-jének csökkenését eredményezi, ami klasszikusan a bázisokat jobban érinti, mint a csúcsokat.
- A patológiának ez az intrapulmonális differenciáltsága az oxigenizációs stratégiákra adott eltérő választ eredményez. Míg a megnövelt pozitív véglégzési nyomás (PEEP) javíthatja az oxigéndiffúziót az érintett alveolusokban, káros volutraumát és a szomszédos, nem érintett alveolusok atelektraumáját eredményezheti.
Ez a 100 másodperces videó jó bevezetés az ARDS-be
Celluláris érintettség az ARDS-ben:
- Neutrofilek: Legnagyobb számban mind a hámbélés, mind az alveoláris szövettani mintákban előfordulnak. Bár a hámot átszelő neutrofilek kemotaxikus jellege nem okoz károsodást, pro-inflammatorikus jellegük miatt reaktív oxigénfajok, citokinek és számos gyulladásos mediátor szabadul fel, amelyek hozzájárulnak a bazálmembrán károsodásához.
- Alveoláris makrofágok: Ezek a leggyakoribb sejttípus, és az intersticiális makrofágokkal együtt fontos szerepet játszanak a védekezésben. ARDS-es betegeknél az alveoláris makrofágok számának progresszív növekedése figyelhető meg.
- Epithelium: Az alveoláris hámszövetben találhatóak a nagy metabolikus aktivitású 2-es típusú alveoláris sejtek. A károsodott epithelium diszfunkcionális surfactant
Klinikai megjelenés és értékelés
A szindróma jellemzője :
- A dyspnoe és hypoxémia kialakulása, amely órák és napok alatt fokozatosan romlik, gyakran gépi lélegeztetést és intenzív osztály szintű ellátást igényel.
- A kórelőzmény a betegséget előidéző kiváltó kiváltó ok azonosítására irányul.
- A kommunikációra képes betegek kikérdezése során gyakran kezdetben enyhe dyspnoe-ról panaszkodnak, de 12-24 órán belül a légzési distressz eszkalálódik, súlyossá válik, és a hypoxia megelőzése érdekében gépi lélegeztetést igényel.
- Az etiológia nyilvánvaló lehet COVID 19, pneumónia vagy szepszis esetén. Más esetekben azonban a beteg vagy a hozzátartozók kikérdezése a közelmúltbeli expozíciókról szintén kiemelkedő jelentőségű lehet a kórokozó azonosításában.
A fizikális vizsgálat során
- Akut gyulladásos fázist találhatunk: 3-10 napig tart és hypoxaemiát és többszervi elégtelenséget eredményez. A betegek jellemzően progresszív dyspnoe, tachypnoe, cyanosis, hypoxiás zavartság és tüdőkrepitációval jelentkeznek.
- Szisztémás tünetek (a betegség súlyosságától függően) pl. centrális vagy perifériás cyanosis a hypoxaemia következtében, tachycardia és megváltozott mentális állapot.
- A 100%-os oxigén ellenére a betegek oxigénszaturációja alacsony. A mellkasi auskultáció általában zörejeket mutat, különösen bibasilaris, de gyakran az egész mellkasban auskultálható.
- Gyógyulás, proliferatív fázis: Ebben a fázisban gyakori a tüdő hegesedése és a pneumothorákia
Megjegyzendő, hogy mindkét fázisban előfordulhatnak másodlagos szisztémás és mellkasi fertőzések.
Diagnosztikai eljárások
A National Heart, Lung and Blood Institute szerint a diagnózis felállítása a kórtörténet, a fizikális vizsgálat és a vizsgálati eredmények vizsgálata révén történik.
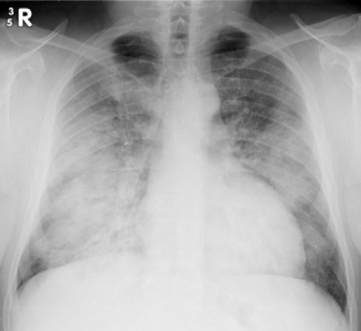
Kórelőzmény
- Szívelégtelenség
- Volt-e a betegnek az ARDS bármely közvetlen vagy közvetett klinikai kockázati tényezője?
Fizikai vizsgálat
- Hozzáadott légzési hangok auskultáción (pl.g recsegés)
- Szív auskultáció
- Cianózis
Vizsgálati eredmények
- Arteriális vérgázok
- Mellkas x-ray
- Vérvizsgálatok
- Köpetkultúra
- CT vizsgálat
- Szívelégtelenség vizsgálata
Kezelés / beavatkozások
Sajnos, egyetlen gyógyszer sem bizonyult hatékonynak az ARDS megelőzésében vagy kezelésében.
A fő kezelési stratégia a szupportív ellátás, és a
- söntfrakció csökkentésére,
- az oxigénszállítás növelésére
- az oxigénfogyasztás csökkentésére,
- a további károsodás elkerülésére összpontosít.
A betegeket mechanikusan lélegeztetik, diuretikumokkal védik a folyadéktúlterheléstől, és táplálkozási támogatást kapnak, amíg a javulás bizonyítékát nem észlelik.
A beteg lélegeztetésének módja hatással van a tüdő regenerálódására. Bizonyított, hogy egyes lélegeztetési stratégiák súlyosbíthatják az alveoláris károsodást és állandósíthatják a tüdőkárosodást ARDS-ben.
- Gondoskodni kell a volutrauma (nagy légzési térfogatoknak való kitettség), a barotrauma (magas platónyomásnak való kitettség) és az atelectrauma (atelectasisnak való kitettség) megelőzéséről.
Az ARDS lehetséges beavatkozásai
NB Mérlegelje a beavatkozás kockázatát és hasznát, különösen, ha a tüdő olyan törékeny
- Szívás (nyitott / zárt)
- Lélegeztetőgépes hiperinfláció (VHI)
- Pozicionálás (lásd alább).
Ventilátoros hiperinfláció (VHI)
Anderson és munkatársai (2015) szisztematikus áttekintése úgy vélte, hogy mind a manuális, mind a lélegeztetőgépes hiperinfláció hasonló hatással van a szekréciós clearance-re, a pulmonális compliance-re, javítja az atelektázist és az oxigenizációt a kardiovaszkuláris stabilitás káros kockázata nélkül. A beavatkozás során azonban végig manométert kell használni, különös tekintettel az ellenjavallatokra.
Az ARDS-betegeknél a tüdőrekrutáció fenntartásához szükséges magas PEEP-szintek miatt ideális a lélegeztetőgép használata a hiperinfláció kivitelezéséhez. Emellett a VHI lehetővé teszi a légúti nyomások folyamatos nyomon követését és ellenőrzését, ami lehetővé teszi az adagolás megfelelő titrálását.
Fekvő helyzetbe helyezés
Az ARDS-beteg fekvő helyzetbe helyezése a betegek körülbelül 70%-ánál jelentős PaO2-növekedést eredményez. A beteg hasonfekvésbe helyezésével javul a tüdő dorzális oldalának rekrutációja, ami egyenletesebb perfúziót és jobb V/Q illeszkedést eredményez.

A bizonyítékok azt mutatják, hogy a hasonfekvés előnyös, különösen a súlyosan hipoxaémiás/súlyos ARDS-ben szenvedők esetében, és csökkenti az intenzív osztályos halálozást, a légúti szövődmények növekedése nélkül.
- Magyarázza el a betegnek, megnyugtatva, hogy biztonságban lesz, és kérjen beleegyezést, ha képes kommunikálni.
- Zárja be a szemét, és védje géllel vagy betéttel.
- Tegye a beteg tenyerét a combjához, hüvelykujját felfelé, könyökét egyenesre, vállát semlegesre.
- Csúsztassa a beteget a szélére egy csúszó lepedő segítségével.
- Tekerje a beteget oldalsó helyzetbe az alatta lévő lepedő segítségével.
- Tekerje a beteget hason fekvő helyzetbe.
- “Úszópóz” – a könyököt, amelyben a fej félig el van forgatva, legfeljebb 90°-ra kell hajlítani a singcsonti ideg megnyúlásának elkerülése érdekében, és a másik karral belsőleg oldalra kell forgatni.
- Vigyázzunk arra, hogy a női melleket vagy a férfi nemi szerveket ne nyomjuk össze.
- Tegyen két párnát mindkét sípcsont alá, hogy elkerülje a peroneus ideg nyújtását, és úgy helyezze el őket, hogy a matrac ne nyomja a térdet és a lábujjakat.
Mechanikus lélegeztetés
A megnövekedett légzési munkával járó, akutan fellépő hipoxaemiás légzési elégtelenség következtében gyakori a mechanikus lélegeztetés. Az ARDS patofiziológiája és különösen a rostosodási aspektus azt jelenti, hogy a támogatás módját és adagolását alaposan meg kell fontolni annak érdekében, hogy a lélegeztetőgép okozta tüdőkárosodás (VLII) ne következzen be
Az ARDS-es betegnél a PEEP-t és a légzési térfogatot csökkenteni kell, hogy tükrözze a tüdő levegőztetésre rendelkezésre álló részeit. Ha ez nem történik meg, akkor ez a tüdő túlnyújtásához vezethet, amit a tüdő csökkent compliance-ja miatt volutraumának nevezünk. Az alveolusok ismétlődő nyitása és záródása a légzéses felfúvódás során szintén a tüdőszövet sérülését okozhatja, amit alektotraumának nevezünk. Ha a mechanikai támogatást nem a betegre szabjuk, mind az alektotrauma, mind a volutrauma növelheti a tüdőszövetben lévő citokinek számát, amelyek aztán a szisztémás keringésbe kerülhetnek, és potenciálisan többszervi elégtelenséghez vezethetnek
Az alábbi grafikon, bár talán túlzottan leegyszerűsítve, megpróbálja kiemelni az ARDS-es beteg lélegeztetésének optimális területét. Az alsó inflexiós pont (LIP) feltételezhetően az a nyomás, amelynél a tüdőszövet rekrutálódik. A felső inflexiós pont (UIP) az a hozzávetőleges nyomás, amelynél az alveolusok túlságosan kitágulnak, ami potenciálisan károsodáshoz vezethet. Ezért a legoptimálisabb lélegeztetési pozíció a két inflexiós pont között, a görbe legmeredekebb, legnehezebb részén van.

Moloney és Griffiths (2004)
Inverse Ratio Ventilation (IRV)
Ez a lélegeztetési mód a normál 1:2 inspirációs/expirációs arány 1:1 vagy 2:1 arányúvá változtatását igényli. Míg ez a lélegeztetési mód a rosszul engedékeny tüdő levegőztetésének és kollaterális szellőztetésének fokozását célozza, a csökkent kilégzési idő a PCO2 emelkedését eredményezheti. Ha azonban a hiperkapnikus acidózis lassan következik be, akkor az intracelluláris acidózis jól kompenzálódik, azonban a hiperkapnia minden formáját kerülni kell ebben a helyzetben vagy azoknál, akiknél fennáll az emelkedett intrakraniális nyomás kialakulásának kockázata. Ez az úgynevezett megengedő hiperkapnia.
Kotani és munkatársai (2016) közelmúltbeli, bár kis létszámú tanulmánya kimutatta, hogy az IRV 13 ARDS-ben szenvedő személy esetében komplikációk nélkül elfogadható gázcserét biztosított.
Légúti nyomáskioldó ventilláció (APRV)
A mechanikus lélegeztetés ezen formája CPAP adagolását jelenti, intermittáló kioldási fázissal. A CPAP hosszú időn keresztül történő adagolásáról úgy gondolják, hogy fenntartja a megfelelő tüdőtérfogatot és az alveoláris rekrutációt, ahol az elengedés célja a CO2 eltávolításának elősegítése. Az inspiráció kedvezőbb nyomás-térfogat viszonyból indul, így segítve az oxigenizációt.
Nagyfrekvenciás oszcilláció (HFO)
A HFO-nál folyamatos tágító nyomást (CDP) állítanak be, és egy oszcillációs pumpával nagy frekvenciával kis tidális térfogatokat juttatnak be. A korábban leírtakhoz hasonlóan ez is a tüdővédő lélegeztetés egy másik formája, folyamatos tüdőrekrutációval. Bár Sud és munkatársai (2010) szisztematikus áttekintése szerint a HFO javíthatja a túlélést, és valószínűleg nem okoz kárt, csak 8 tanulmányt elemeztek, kevés beteggel és széles konfidenciaintervallummal. Arról sem számoltak be, hogy a kimenetelt értékelőket elvakították volna, így a vizsgálatokban fennáll a torzítás veszélye.
Extrakorporális membránoxigenizáció (ECMO)
Az ECMO olyan betegeknél alkalmazható, akiknek súlyos légzési elégtelenségük van, és akkor alkalmazzák, ha a hagyományos terápia nem képes megfelelő oxigénellátást fenntartani. Az ECMO teljes mértékben helyettesítheti a tüdő funkcióját, azonban a különböző szövődmények miatt mérlegelni kell a kockázatot az előnyökkel szemben.
Az ECMO egy oxigenizátoron és egy szivattyún keresztül kialakított extrakorporális vérkörből áll. Két vaszkuláris hozzáférést alakítanak ki, az egyik a vénás vért távolítja el, a másik pedig az oxigéndús vért infundálja. Miután a vért eltávolították egy nagyobb vénából, a vért egy oxigenátort tartalmazó áramkörön keresztül pumpálják, amely oxigenizálja a vért és eltávolítja a szén-dioxidot. Ezután a vért a másik kanülön keresztül visszajuttatják.
Inhalált nitrogén-monoxid
A nitrogén-monoxid nemcsak az endothelből származó simaizomrelaxáns, hanem segíti a neurotranszmissziót, a gazdaszervezet védelmét, a vérlemezkék aggregációját és a hörgőtágulást is. Az inhalált nitrogén-oxidot folyamatosan vagy intermittáló belégzéses injekcióval lehet adagolni, és a PaO2 20%-os emelkedése pozitív válasznak számít. Az ARDS-betegek 40-70%-ánál javul az oxigenizáció az inhalált nitrogén-oxid hatására, és csak súlyos hipoxémiában szenvedő betegeknél szokták alkalmazni átmeneti mentőszerként.
A fizioterapeuta szerepe
A fizioterápia hozzájárulása gyakran korlátozott és minimális, gyakran a magas PEEP és a magas oxigénigény miatt. Mivel intersticiális patológiáról van szó, a szekréció általában nem jelent problémát. A kezelés csak pozícionálásból állhat, pl. hason fekvés a gázcsere optimalizálása érdekében. A gyakorlati technikákkal óvatosan kell eljárni, mivel biztosítani kell, hogy a lélegeztetőgép PEEP-jének sínező hatását elveszítő tüdőegységeket ne vonjuk vissza. Ha a váladékképződés problémát jelent, gondoskodjon a megfelelő párásításról, valamint a köpetürítés javítását célzó egyéb technikákról. Minimális szívás ETT-n keresztül. Egy korszerű áttekintés szerint az akut tüdőbetegségben szenvedő csecsemőknél és gyermekeknél kerülni kell az ismételt légúti tisztítást.
Következtetések
- Bár az ARDS számos kockázati tényezője ismert, az ARDS megelőzésére nincs mód.
- A nagy kockázatú betegeknél a folyadékok gondos kezelése hasznos lehet.
- Lépéseket kell tenni az aspiráció megelőzésére azáltal, hogy az etetés előtt az ágy fejét megemelve tartjuk.
- Az ARDS nélküli, nagy kockázatú betegeknél a tüdővédő mechanikus lélegeztetési stratégia segíthet az ARDS megelőzésében.
Források
- Cochrane Review: Recruitment maneuvres for adults with acute respiratory distress syndrome receiving mechanical ventilation
- Cochrane Review:
- Cochrane Review: Pressure-controlled versus volume-controlled ventilation for acute respiratory failure due to acute lung injury (ALI) or acute respiratory distress syndrome (ARDS)
- Cochrane Review: Cochrane Review: High versus low positive end-expiratory pressure (PEEP) levels for mechanical ventilated adult patients with acute lung injury and acute respiratory distress syndrome
- Cochrane Review:
- Akut légzési distressz szindróma. A berlini definíció
- ARDSNet: Mechanikus lélegeztetés protokoll-összefoglaló