Amfetaminok | Addiktív betegségek
Az amfetamin eredete
Az amfetamint először 1887-ben szintetizálta L. Edelano. 1920-ban Gordon Alles felfedezte, hogy az alapvegyület, az amfetamin-szulfát és még aktívabb dextroizomerje, a dextroamfetamin-szulfát képes stimulálni a központi idegrendszert (CNS). 1931-ben az Egyesült Államokban a gyógyszerészeti laboratóriumok elkezdték tanulmányozni, és öt évvel később, a szesztilalom idején a Smith Kline & French, az Alles szabadalmait megszerző gyógyszeripari vállalat Benzedrine® (a törzsvendégeknek Bennie) kereskedelmi néven bevezette az orvosi gyakorlatba. Szinte azonnal piacra került aktívabb izomerje, a Dexedrine® (dexies) néven forgalmazott dextroamfetamin. Miután felvették őket a szabályozott anyagok jegyzékébe, az amfetamin mindkét típusa megjelent az észak-amerikai feketepiacon a szubjektív hatásaikhoz kapcsolódó nevek alatt, mint például speed és upper.
Szerkezet és osztályozás
Az amfetaminok szimpatomimetikus aminok, amelyek szerkezeti kémiai képlete hasonló az adrenalinéhoz (1. ábra). A két leggyakrabban használt amfetamin, amelyekből e csoport legmodernebb drogjai származnak: a d-amfetamin-szulfát vagy d-fenilizopropilamin (dexedrin), amely megfelel az anyag dextrorotációs izomerjének, és a racém amfetamin-szulfát (benzedrin) (2. ábra). A dextrorotatorikus vegyület (dexedrin vagy d-benzedrin) kétszer olyan aktív, mint a racém vegyület (benzedrin) és négyszer olyan aktív, mint a levorotatorikus vegyület. Farmakológiai szempontból, ahogy az adrenalinhoz hasonló kémiai szerkezetű vegyület az adrenalintól az amfetaminok felé mozdul el, növeli a központi idegrendszeri stimuláló hatását, és csökkenti a periférián (neurovegetatív rendszerben) kifejtett aktivitását.
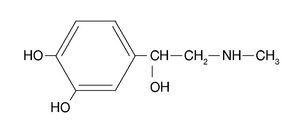
1. ábra. Az adrenalin kémiai szerkezete.
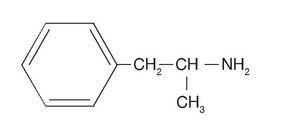
2. ábra A dl-amfetamin kémiai szerkezete.
A leggyakrabban használt amfetamin pszichostimuláns készítmények közé tartozik az amfetamin, a fentermin, a klórfentermin és a metamfetamin (3. ábra), ez utóbbi nagy jelentőségű, mivel ez az alapja az MDMA (3,4-metiléndioxi-metamfetamin; ecstasy) csoportnak. Számos, a heterociklikus aminok nem amfetamin csoportjába tartozó, piperdin-ecetsavból nyert vegyület is megjelent, mint például a metilfenidát és a pripadol. Egyéb heterociklikus aminok közé tartozik a facetoterán és a fenmentracin. Ezek a gyógyszerek viszonylag új keletűek, bár a növényt, amelyből az efedrin származik (Catha edulis), már ősidők óta használják az asztma kezelésére. Az 1960-as évektől kezdve a reklámok újra divatba hozták az amfetamin használatát étvágycsökkentő (anorexiás) tulajdonságai miatt.
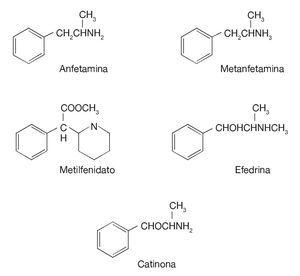
3. ábra. Az amfetamin és néhány származékának kémiai szerkezete.
A hatásmechanizmus
Az amfetaminok hatásmechanizmusa több neurotranszmitter, például a dopamin, a szerotonin, az adrenalin és a noradrenalin bevonásával történik.
Növeltebb dopaminfelszabadulás
A neurotranszmitter megnövekedett koncentrációja a szinaptikus térben mind a visszavétel blokkolásával – a kokainéhoz hasonló, de más rögzítési ponttal rendelkező mechanizmus révén -, mind pedig a fokozott felszabadulással történik, mivel a d-amfetamin képes behatolni a neuronba és kiszorítani a dopamint a nem granuláris citoplazmatikus raktárakból (ábra. 4), az ezt követő neurotranszmitter-deplécióval1,2.
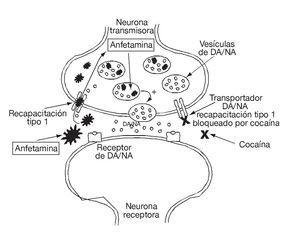
4. ábra Az amfetaminok dopaminerg és noradrenerg neurotranszmitterrendszerre gyakorolt hatásmechanizmusának sematikus ábrája. DA: dopamin; NA: noradrenalin.
A dopamin ezen növekedése a laterális hipotalamusz területein dózisfüggően szabályozza az étvágyérzetet. Míg a nigrostriatális és mezokortikolimbikus pályák emelkedett dopaminszintje (5. ábra) szerepet játszik az amfetamin pszichostimuláns és jutalmazó tulajdonságaiban.
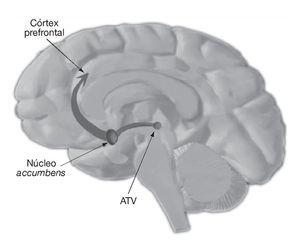
5. ábra. VTA: ventrális tegmentális terület.
A szerotonin visszavétel gátlása
Az amfetamin növeli az extracelluláris szerotonin3 koncentrációt azáltal, hogy kiszorítja a neurotranszmittert a specifikus preszinaptikus transzporteréből. Amikor az amfetamin a szerotonin-transzporterekhez kötődik, megakadályozza, hogy a szerotonin belépjen a terminálba, és megfordítja a visszavételi mechanizmust, így a szerotonin a szinaptikus térbe távozik. Ez a mechanizmus szelektívebbnek tűnik az olyan gyógyszerek esetében, mint a fenfluramin és a dexfenfluramin, amelyek szintén felszabadítják a szerotonint intracelluláris raktáraikból, és képesek aktiválni az 5-HT1 receptorokat. Az amfetaminok által kiváltott anorexiás hatásban a megnövekedett szerotoninszint is szerepet játszik.
Noradrenalin fokozott felszabadulása
Az amfetaminok elősegítik a noradrenalin felszabadulását azáltal, hogy a visszavételi mechanizmus révén az idegvégződésekhez szállítódnak (4. ábra). Az idegvégződésekbe érve a vezikuláris transzporter veszi fel őket a noradrenalinért cserébe, amely a citoszolba távozik. Csak gyengén hatnak az adrenerg receptorokra. Ez a mechanizmus részben megmagyarázná az amfetaminok központi hatásait, például a fokozott motoros aktivitást, a csökkent fáradtságot és az ezeket a szereket kísérő perifériás hatásokat, például a tachycardiát, az izzadást és a vizelési nehézségeket.
A vezikuláris monoamin transzporter károsodása
A vezikuláris monoamin transzporter (VMAT2) főként a központi idegrendszerben található, és a citoplazmában lévő monoaminok tároló vezikulákba történő szállításáért felelős. Az amfetaminok megzavarhatják a protongradienst e szinaptikus vezikulák membránjában, és ezáltal a működésüket. Így megfordítják e transzporterek áramlását, ami a noradrenalin, dopamin és szerotonin citoplazmatikus koncentrációjának növekedéséhez vezet. Mivel a VMAT2 szerepet játszhat az amfetaminok által kiváltott lokomotoros stimulációban és megerősítő tulajdonságokban, célpontja lehet a pszichostimulánsok használatához kapcsolódó addiktív folyamatok terápiás stratégiáinak kialakításában4.
Az amfetaminok farmakológiai hatásai
Perifériásan
Az amfetaminok perifériás érszűkületet és ennek következtében a szisztolés és diasztolés vérnyomás emelkedését okozzák. Béta-adrenerg hatás révén növeli a pulzusszámot, bár reflexszerűen is csökkenhet. A simaizomzat szintjén összehúzza a szivárványhártya sugárirányú izmait, ami mydriázist és megnövekedett intraokuláris nyomást eredményez. Csökken a perisztaltika és a váladékképződés. Béta-adrenerg hatás révén ellazítja a hörgő izomzatot. Összehúzza a húgyhólyag záróizmát, így nehezíti a vizelést.
A központi idegrendszer szintjén
Az amfetaminok éberségérzetet, stimulációt, jobb szellemi teljesítményt és a manuális feladatok elvégzését, energiaérzetet, csökkent fáradtságot, alvást és éhségérzetet okoznak. Nagy a visszaélés lehetősége, és függőséget okozhatnak. Kísérleti állatokban az amfetaminok dózisfüggően fokozzák a mozgásszervi aktivitást, és nagy dózisban sztereotípiákat okoznak. Felmerült, hogy az emberekben a falásrohamok az állatokban megfigyelhető sztereotip viselkedés megnyilvánulása lehet.
Tolerancia
Az amfetaminok és származékaik ismételt alkalmazását követően mind a szubjektív, mind az objektív hatások a tolerancia jelenségének mennek keresztül, oly módon, hogy nagyobb dózisok szükségesek ugyanannak a hatásnak az eléréséhez.
Ez a tolerancia lehet krónikus vagy akut (tachyphylaxis). A tolerancia vagy deszenzitizáció javasolt mechanizmusa a receptor foszforilációját foglalja magában, amely a G-fehérje és maga a receptor közötti szétkapcsolódást idézi elő5. Mind a krónikus, mind az akut tolerancia részben felelős az amfetaminszármazékokkal való visszaélésre való hajlamért a stimuláns hatások keresése érdekében. A tachifilaxia viszont életveszélyes túladagoláshoz vezethet. Klinikailag megfigyelték az amfetamin típusú szimpatomimetikus szerek közötti kereszttoleranciát, és patkányoknál kimutatták a kokain és az amfetamin anorexiás hatása közötti kereszttoleranciát. Emellett leírták a fordított toleranciát vagy szenzitizációt, amely az amfetaminszármazékok használatára jellemző, és a szokásos adagok bevitelét követően túladagolási állapotként jelentkezik.
Szenzitizáció
A viselkedésbeli szenzitizáció az amfetaminra való fokozott érzékenységet jelenti ismételt beadást követően. A ventrális tegmentális terület (VTA) szerepet játszik az amfetamin által közvetített viselkedési szenzitizáció indukciójában6. A szenzitizáció kifejeződése feltehetően a preszinaptikus D2 dopaminerg receptorok deszenzitizációjának köszönhető, amelyek negatívan modulálják a dopamin felszabadulását egyes agyterületeken, például a nucleus accumbensben. Így a gyógyszer beadása a szinaptikus dopamin további növekedését eredményezi, ami a hatás intenzitásának növekedésével jár. A szenzibilizáció hosszan tartó lehet, és úgy tűnik, hogy gyorsabban alakul ki, ha a gyógyszert szakaszosan adják. Nemrégiben egy másik mechanizmust is leírtak, amely megpróbálja megmagyarázni az érzékenyítést. Így az amfetaminok (d-amfetamin és fenfluramin) képesek kihasználni a szerotonin preszinaptikus transzporterét azáltal, hogy kiszorítják azt, így megakadályozzák a szerotonin intracelluláris eloszlásához vezető foszforilációt, és növelik a membránban a későbbi dózisok számára rendelkezésre álló transzporterek számát. Az újrafelvételi fehérjéknek ez a membránban történő újraeloszlása képviselheti a stimuláns hatásokra való érzékenyítésben szerepet játszó molekuláris változások egy részét. Úgy gondolják, hogy ez a jelenség felelős a pszichotikus állapotokért, amelyek néha kísérik e szerek használatát.
Függőség
Az amfetaminokat kezdetben egyszeri dózisban veszik be, és eufóriát és megerősödést (kezdeti fázis) okoznak, elsősorban a mezokortikolimbikus pálya dopaminerg termináljaiban (nucleus accumbens és prefrontális kéreg) történő dopaminfelszabadító képességüknek köszönhetően. A fogyasztás növekedésével (konszolidációs fázis) tolerancia alakul ki, amely az adag növelésével vagy az adagolási mód megváltoztatásával leküzdhető. Ebben a szakaszban kezdődik a dopamin kimerülése. A tolerancia kialakul, és az eufória fenntartása érdekében elkezdődik a drogfogyasztás. A tivornya körülbelül 12-48 órán át tart, és az alany kimerülésével ér véget, akinek több napra van szüksége a felépüléshez. Ebben a fázisban a dopaminszint nagyon alacsony, és neuronális károsodás is előfordulhat.
A mentális zavarok IV. diagnosztikai és statisztikai kézikönyvének (DSM-IV) általános visszaélési kritériumai (a függőségnél ritkább használat) érvényesek az amfetaminokra és a szintetikus drogokra. Megfigyelhető, hogy nem engedelmeskednek, kockázatos helyzetekben használják, és használatuk és annak következményei miatt jogi, szociális és interperszonális problémáik lehetnek.
A DSM-IV általános kritériumai az amfetaminfüggőségre az amfetaminokra is vonatkoznak. Az amfetaminfüggőséget intenzív tolerancia, elvonás és a szokásos tevékenységektől való elvonulás kíséri. Ellenállhatatlan igény alakul ki a használatra (sóvárgás). A használat során gyakran jelentkeznek pszichotikus tünetek. A krónikus amfetaminhasználat hirtelen abbahagyását a különböző fázisú elvonási szindróma kialakulása jellemzi. A kezdeti fázis (összeomlás) néhány órán belül kezdődik és legfeljebb 9 napig tart. Diszfória, depresszió, anergia, nyugtalanság, szorongás, álmatlanság, hipersomnolencia, hiperfágia és erős sóvárgás jelentkezik. A köztes vagy elvonási fázis 1 és 10 hét között jelentkezik. Kezdetben fáradtság, energiahiány, anhedónia és depresszió formájában jelentkezik. A sóvárgás csökken, és ha nincs visszaesés, a depressziós tünetek fokozatosan javulnak. A harmadik fázisban, amely határozatlan ideig tart, intenzív sóvárgási epizódok jelentkezhetnek, amelyek általában kondicionált jelekhez kapcsolódnak, és amelyek a beteg visszaesését okozhatják. Nagy adagokat fogyasztó alanyoknál öngyilkossági gondolatok léphetnek fel. Hasonló képet írtak le a kokain esetében is. Az amfetaminfüggőségre nincs specifikus farmakológiai kezelés. Mivel úgy tűnik, hogy az elvonás során csökkenhet a dopaminszint, dopamin-agonistákat és antidepresszánsokat alkalmaztak. A pszichotróp gyógyszerekkel elért eredmények kiábrándítóak. A pszichoterápia hasznos lehet. Az amfetamin okozta rendellenességeket tüneti kezeléssel, a pszichotikus megnyilvánulásokra antipszichotikumokkal, a szorongásra és pánikrohamokra vagy szorongásos zavarra pedig anxiolitikumokkal kezelik. A metamfetamin farmakológiai hatásait nemrégiben áttekintették7.
Metamfetamin neurotoxicitás
Az anyag okozta neurotoxicitást a CNS-ben bekövetkező káros strukturális vagy funkcionális változásként határozzák meg. Így az amfetaminok által okozott neurotoxicitás általában a neurokémiai és neuronális szintű tartós változásokra utal, beleértve az axonok és a monoamintartalmú végződések károsodását. Patkányoknál és majmoknál a metamfetamin beadása a dopamin és metabolitjainak csökkenését eredményezi8. Patkányokban a metamfetamin csökkenti a szerotoninszintet, a dopamin- és szerotonin-visszavételi helyeket, csökkenti a neurotranszmitter-szintézisben részt vevő enzimek (tirozin-hidroxiláz és/vagy triptofán-hidroxiláz) aktivitását, és morfológiai változásokat okoz a neuronokban9. A neuronok szerkezeti változásai az axonokban figyelhetők meg, és magukban foglalják a varikozitások megjelenését, valamint az axonok csökkenését és elszegényedését. A metamfetamin neurotoxicitás kialakulását befolyásoló tényezők közé tartoznak az alkalmazott dózisok, a droggal való expozíciók száma, az adagok közötti intervallum és az az idő, amíg az idegsejtek ki vannak téve a drognak. Bár a humán adatok nagyon korlátozottak, néhány vizsgálat arra utal, hogy a metamfetamin emberekben tartós dopaminerg neurotoxicitást okozhat, amely funkcionális változásokkal jár, de az érintett neuronok bizonyos mértékű regenerálódását is megfigyelték több hónappal a drogfogyasztás abbahagyása után10.
Neurobiológiai vizsgálatok laboratóriumi állatokon
Effektusok a mozgásszervi aktivitásra
Az amfetaminok központi stimulációt11 okoznak, amely kifejezéssel az állatok mozgásszervi aktivitására, valamint az alvásra és az elektroenkefalográfiás aktivitásra gyakorolt hatásukat jellemzik. Kezdetben az amfetamin éberségi állapotot idéz elő, amelyet a felfedező viselkedés, az ápolás, a vertikális és horizontális mozgás növekedése kísér, majd e tevékenységek csökkenése a sztereotip viselkedés javára (fordított U alakú dózisválasz). Neuroanatómiai vizsgálatok azt mutatják, hogy az amfetaminok által kiváltott mozgásszervi aktivitásnövekedés a nigrostriatális és mezolimbikus dopaminerg rendszertől függ. Ezenkívül a noradrenalin központi felszabadulása fontos lehet a hiperlokomócióban. Másrészt úgy tűnik, hogy a sztereotípiákat az újonnan szintetizált dopamin felszabadulása közvetíti a nigrostriatális és mezolimbikus dopaminerg pályákon, és a dopaminerg és a kolinerg rendszer közötti egyensúly szabályozza.
Az agresszív viselkedésre gyakorolt hatások
Az amfetamin agresszív viselkedésre gyakorolt hatása állatokban összetett, és függ a beadott dózistól és az alkalmazott kísérleti paradigmától. A környezeti tényezők és a genetikai tényezők szerepe ezekben a hatásokban szintén fontos. Az amfetaminok mind az állatokban, mind az emberekben szélsőséges agresszivitást, valamint a társas kapcsolatoktól való elvonulást okozhatnak. Az amfetamin agresszív viselkedésre gyakorolt többszörös hatásában szerepet játszó neurobiológiai mechanizmusokat összekapcsolták a pszichostimuláns tulajdonságaihoz kapcsolódó mechanizmusokkal. Az egyik paradigma, amelyet ezen anyagok agresszív viselkedésre gyakorolt hatásának tanulmányozására használnak, a betolakodó teszt. Ez a teszt egy helyben lakó állat és egy betolakodó közötti konfrontációt foglal magában, és olyan biológiailag érvényes viselkedési formákat vizsgál, mint a behódolás, a védekező viselkedés, a támadás és a menekülés. Így az amfetamin különböző kísérleti körülmények között és különböző állatfajoknál bizonyítottan fokozza a védekező és menekülő viselkedést, és úgy tűnik, hogy ezt a hatást nem a központi dopaminerg rendszer közvetíti. A dopamin-antagonisták azonban visszafordítják a kis dózisú amfetamin akut adagolása által kiváltott agresszív viselkedést erősítő hatásokat.12
A tanulásra gyakorolt hatások
A legtöbb állatkísérlet arra utal, hogy az amfetamin nem zavarja a tanulást, sőt bizonyos körülmények között fokozza azt. Vannak azonban olyan adatok is, amelyek káros hatásokat mutatnak13. Jól bizonyított tény, hogy az amfetamin hatására történő tanulás elsajátítására jobban emlékeznek, ha a vizsgálat napján nem sóoldatot, hanem amfetamint adnak be. Ezenkívül az amfetamin megvonás során az amfetamin hatására megtanult viselkedés zavarai jelentkeznek. Így kimutatták, hogy az amfetamin által az állatban létrehozott belső állapot befolyásolja az amfetamin hatására tanult feladatok tanulását (állapotfüggő tanulás). Ez a belső állapot diszkriminatív ingerként szolgál. Neurofarmakológiai vizsgálatok azt mutatják, hogy az amfetamin által kiváltott állapotot a dopaminerg neurotranszmitterrendszer közvetíti a mezolimbikus pálya szintjén. Fontos, hogy az amfetamin diszkriminatív tulajdonságait nem hozták összefüggésbe pszichostimuláns hatásaival14.
Pozitív megerősítő hatások
Az intracerebrális önstimuláció technikáját használták az amfetamin “jutalmazó” hatásainak értékelésére. Ez azon a tényen alapul, hogy bizonyos agyi területek elektromos ingerlése kellemes érzést kelt. A kábítószerekkel való visszaélés közös tulajdonsága, hogy euforizáló tulajdonságaiknak köszönhetően elősegítik e központok elektromos stimulációját. Az amfetamin fokozza az intrakraniális önstimulációt és csökkenti a viselkedés fenntartásához szükséges áramküszöböt15. Úgy tűnik, hogy az ebben a hatásban szerepet játszó neurokémiai mechanizmus a dopamin és a noradrenalin központi felszabadulása közötti kölcsönhatás16. Másfelől a kábítószerek addiktív potenciálját értékelő tanulmányok nagy része a kábítószerek erősítő tulajdonságainak becslésén alapul, mivel ezek járulnak hozzá leginkább a kényszeres drogkereséshez és visszaéléshez. Így egy kábítószer megerősítő potenciálja, amelyet a kábítószerek állatokban történő intravénás önadagolásának paradigmája határoz meg, a legegyértelműbb mutatója a kábítószer emberekre gyakorolt addiktív potenciáljának. E tekintetben kimutatták, hogy az amfetamin patkányokban17 és majmokban18 önadagoló viselkedést vált ki. Úgy tűnik, hogy az amfetamin megerősítő tulajdonságait a mezolimbikus dopaminerg neuronokra gyakorolt hatásán keresztül fejti ki. Így az amfetamin perifériás beadása növeli az extracelluláris dopaminszintet a patkányok nucleus accumbensében2 , és a nucleus accumbens dopaminerg termináljainak pusztulása blokkolja az amfetamin önadagolását. Számos tanulmány kimutatta, hogy a mezolimbikus dopaminerg neuronok szenzibilizációját előidéző amfetamin-kezelések fokozzák a pszichostimulánsok keresését és az önadagoló viselkedést19 . A gamma-aminovajsav B (GABAB) receptorok baclofen perifériás adagolásával történő stimulálása szintén csökkentette az amfetamin önadagolását és az extracelluláris dopamin koncentrációt a patkány nucleus accumbensében20.
Hatások embereken
Szubjektív hatások
A főbb amfetaminok beadása embereken stimuláló hatást vált ki, jólétérzéssel, eufóriával, energiával, csökkent fáradtsággal és alvással, éberségérzettel, javuló szellemi és pszichomotoros teljesítménnyel, valamint csökkent éhségérzettel. A hatás a beadást követően egy órával kezdődik, 1-3 órán belül maximális, és akár 8-12 órán keresztül is fennállhat21. Amikor a kellemes hatások elmúlnak, “összeomlás” érzése jelentkezhet, diszfóriával, fáradtsággal, depresszióval, levertséggel, ingerlékenységgel, álmatlansággal vagy álmossággal. Ezek az összeomlások intenzívebbek, ha az amfetaminhasználat magas vagy ismétlődő volt. Gyakran egy vagy két napig kényszeresen fogyasztják őket (binge), és az egyén a fizikai és mentális kimerültség állapotába kerül (comedown). Több napig is eltarthat, amíg az egyén felépül, amíg újabb tivornya kezdődik.
Farmakokinetika
Az amfetamin a szájon át történő bevételt követően gyorsan felszívódik. A legmagasabb plazmaszintek 1-3 órán belül jelentkeznek, a fizikai aktivitástól és a gyomorban lévő étel mennyiségétől függően. A teljes felszívódás általában 4-6 órával a lenyelés után következik be. Az amfetaminok a vesében, a tüdőben, az agy-gerincvelői folyadékban és az agyban koncentrálódnak. Ezek erősen lipofil anyagok, amelyek könnyen átjutnak a vér-agy gáton. A normális megoszlási térfogat 5 l/kg testsúly. Normál körülmények között az amfetamin körülbelül 30%-a metabolizáció nélkül ürül ki a vizelettel. Ez a kiválasztás azonban a vizelet pH-értékétől függően változik. Ha a vizelet pH-ja savas (pH 5,5-6,0), a kiválasztás túlnyomórészt a vizelettel történik, és a kiválasztott dózis közel 60%-át a vese nem változtatja meg. Ha a pH lúgos (pH 7,5-8,0), az elimináció túlnyomórészt deaminálással történik, és kevesebb mint 7% választódik ki változatlan formában. A felezési idő 16 és 31 óra között van. Az amfetamin fő metabolikus útja a citokróm P450 által történő dezaminálást foglalja magában, amelynek során para-hidroxiamfetamin és fenilaceton keletkezik. Ez utóbbi vegyület benzoesavvá oxidálódik, és glükuronsavval vagy glicinnel konjugálva ürül ki. Kis mennyiségű amfetamin oxidáció útján noradrenalinná alakul át. A hidroxiláció során egy aktív metabolit, az O-hidroxinorepinefrin keletkezik, amely pszeudotranszmitterként működik, és közvetítheti a gyógyszer egyes hatásait, különösen krónikus felhasználóknál.
Kölcsönhatások
Acetazolamid: növelheti az amfetamin plazmakoncentrációját.
Alkohol: növelheti az amfetamin plazmakoncentrációját.
Aszkorbinsav: a vizelet pH-értékének csökkentése révén fokozhatja az amfetamin kiválasztását.
Furazolidon: az amfetaminok a furazolidonnal kezelt betegeknél hipertóniás választ válthatnak ki.
Guanethidin: az amfetaminok gátolják a guanethidin vérnyomáscsökkentő hatását.
Haloperidol: korlátozott bizonyíték van arra, hogy a haloperidol gátolhatja az amfetamin hatását. Ennek a kölcsönhatásnak a klinikai jelentősége azonban nem bizonyított.
Lítium-karbonát: van néhány elszigetelt bizonyíték arra, hogy ez az anyag gátolhatja az amfetamin hatását.
Monoamino-oxidáz (MAO): az amfetaminok MAO-gátlóval kezelt betegeknél magasvérnyomás-betegséget okoznak.
Noradrenalin: az amfetamin visszaélés fokozhatja a noradrenalin érösszehúzó reakcióját.
Fenotiazinok: az amfetamin gátolhatja ezen anyagok antipszichotikus hatását, a fenotiazinok pedig gátolhatják az amfetamin anorexiás hatását.
Nátrium-bikarbonát: ezen anyag nagy dózisai gátolják az amfetamin kiürülését, ezáltal fokozva annak hatását.
Tabakhasználat: úgy tűnik, hogy az amfetamin dózisfüggő mértékben fokozza a dohányzást.
Triciklikus antidepresszánsok: elméletileg fokozzák az amfetamin hatását. Erre azonban nincs klinikai bizonyíték.
Nemkívánatos hatások emberekben
A nemkívánatos hatások részben a farmakológiai hatások következményei. Ezek bármikor előfordulhatnak, olyannyira, hogy az egyik nap jól tolerált dózisok egy másik napon már nem tolerálhatók, ami nemkívánatos hatásokhoz vezethet. Nem szabad elfelejteni, hogy sok felhasználó ugyanazon az éjszakán több tablettát is bevesz más anyagokkal együtt. Néha nehéz megállapítani a toxicitás okát. Alapvetően két szinten figyelhetők meg a nemkívánatos hatások:
1. Magas vérnyomást, tachikardiát, súlyos ritmuszavarokat, szívizom iszkémiát (angina) és akut szívinfarktust okozhatnak. Ezek a pulmonális hipertónia fokozott előfordulási gyakoriságával járnak együtt. Fejfájás, remegés, izom- és állkapocsfeszülés, szédülés, ataxia, dystonia, görcsök és kóma figyelhető meg. Súlyos, májnekrózissal járó toxikus hepatitiszről számoltak be, amely májátültetést tehet szükségessé. Az emésztőrendszeri hatások közé tartozik a hányinger és hányás, a bénulásos bélelzáródás és a bél ischaemia. Az életveszélyes hatások közé tartozik a subarachnoidalis vérzés, az intrakraniális vérzés, az agyi infarktus és az agyi vénás sinus trombózis.
2. Pszichológiai. Előfordulhat diszfória, álmatlanság, ingerlékenység, izgatottság, ellenségesség és zavartság. Az amfetaminok hatására gyakran jelentkezik agresszió, ami erőszakhoz és kockázatvállaló magatartáshoz vezet. A pszichiátriai zavarok közé tartoznak a szorongás, a szorongásos rohamok, a paranoid téveszmék vagy referenciális téveszmék és a hallucinációk.
Terápiás alkalmazás
Az amfetaminok jelenlegi terápiás javallatai nagyon korlátozottak.
Az elhízás kezelésében az éhség csökkentésére nem javasoltak. Alkalmazásuk egyetlen két javallata a narkolepszia és a figyelemzavar kezelése gyermekeknél. Ezeknél a gyermekeknél a leggyakrabban használt szer a metilfenidát.
Köszönetnyilvánítás
A kutatási munkát a Belügyminisztérium finanszírozta a Nemzeti Kábítószer-ellenes Terven keresztül, a Carlos III Egészségügyi Intézet (FIS 070709) és a Függőségi Rendellenességek Hálózata RD 06/001/001.
A szerző kijelenti, hogy nincs összeférhetetlenség.
A szerző kijelenti, hogy nincs összeférhetetlenség.