Aplastic anemia pathophysiology
Aplastic anemia Microchapters
Home
Patient Information
Overview
Historical Perspective
Classification
Pathophysiology
Causes
Differentiating Aplastikus anémia a other Diseases
Epidemiology and Demographics
Risk Factors
Screening
Natural History, Complications and Prognosis
Diagnosis
Diagnostic Study of Choice
History and Symptoms
Physical Examination
Laboratory Findings
Electrocardiogram
Chest X Ray
CT
MRI
Echocardiography or Ultrasound
Other Imaging Findings
Other Diagnostic Studies
Treatment
Medical Therapy
Surgery
Primary Prevention
Secondary Prevention
Cost-Effectiveness of Therapy
Future or Investigational Therapies
Case Studies
Case #1
Aplastic anemia pathophysiology On the Web
Most recent articles
cited articles
Review articles
CME Programs
Powerpoint diák
Képek
American Roentgen Ray Society Images of Aplastic anemia pathophysiology
All Images X-rays Echo & Ultrahang CT képek MRI
Folyamatban lévő vizsgálatok a Clinical Trials.gov
US National Guidelines Clearinghouse
NICE Guidance
FDA az aplasztikus anémia patofiziológiájáról
CDC az aplasztikus anémia patofiziológiájáról
Aplastic anemia pathophysiology anaemia pathophysiology in the news
Blogok az Aplastic anemia pathophysiology témában
Útvonalak a kórházak felé Aplastikus anémia kezelése
Rizikókalkulátorok és kockázati tényezők az Aplastikus anémia patofiziológiája
Szerkesztő…In-Chief: C. Michael Gibson, M.S., M.D. ; főszerkesztő-helyettes(ek): C. Michael Gibson, M.S., M.D. ; társszerkesztő(k): M: Priyamvada Singh, M.D. Nazia Fuad M.D.
Kérlek, segítsd a WikiDoc-ot a tartalom hozzáadásával. Egyszerű! Kattintson ide a szerkesztés megismeréséhez.
Áttekintés
A csontvelő egy szivacsos szövet, amely a csontok szivacsos vagy tokos részeiben található. Erősen vaszkularizált és gazdagon innervált A csontvelő a vérképzés elsődleges helye, és vérképző sejtekből, csontvelő zsírszövetből és stromasejtekből áll. Az aplasztikus anémia patofiziológiájának legdefenzívebb jellemzője a vérképző őssejtek elvesztése. Ez jelentkezhet vérképzőszervi elégtelenség vagy a csontvelő immunmediált pusztulása formájában. Gyógyszerek, vegyi anyagok, vírusok és különböző mutációk megváltoztatják a HSC-k immunológiai megjelenését, ami a csontvelősejtek autoimmun pusztulásához vezet. Az AA fokozatosan más hematológiai rendellenességgé alakulhat, amelyek közé tartozik a paroxysmalis éjszakai hemoglobinuria , a myelodysplasztikus szindrómák és az akut myeloid leukémia ). A klonális evolúció AA-ban mutációk vagy citogenetikai rendellenességek miatt következhet be. A leggyakrabban mutálódó gének a DMNT3A, ASXL1, BCOR, BCORL1, PIGA.
Patofiziológia
Fiziológia
A csontvelő normális fiziológiája a következőképpen értelmezhető:
- A csontvelő egy szivacsos szövet, amely a csontok szivacsos vagy kancellózus részeiben található
- Ez erősen vaszkularizált és gazdagon innervált
- A csontvelő a vérképzés elsődleges helye.
- Vérképző sejtekből, csontvelő zsírszövetből és stromasejtekből áll.
- A csontvelőben lévő vérképző őssejtek (HSC) a perifériás vér és a szövetek összes érett sejtjének forrása, és multipotensek.
- A HSC-ket immunfenotípusuk alapján ismerik fel és izolálják.
- A HSC-k a csontvelő sejtek CD34+/CD38 frakcióján belül kis populációt alkotnak.
- A vérképződést különböző szabályozó mechanizmusok, többek között növekedési faktorok irányítják.
- A normális csontvelőszerkezet aplasztikus anémia, rosszindulatú daganatok vagy fertőzések következtében károsodhat vagy elmozdulhat.
- Ez a vérsejtek és vérlemezkék termelésének csökkenéséhez vezet.
Patogenezis
Az aplasztikus anémia patofiziológiájának legmeghatározóbb jellemzője a vérképző őssejtek elvesztése.
A HSC-k elvesztését eredményező és aplasztikus anémiát okozó patofiziológiai mechanizmusok a következők:
Hematopoetikus kudarc
- ACD34 sejtek szinte teljesen hiányoznak aplasztikus anémiában.
- Az erythroid, myeloid és megakaryocyták kialakítására képes progenitor sejtek nagymértékben csökkennek.
- A primitív vérképző sejtek, amelyek az őssejtekkel szoros kapcsolatban állnak, következetesen hiányosak.
- A fehérvérsejtek aplasztikus anémiában rövid telomerekkel rendelkeznek.
- A telomerek az eukarióta kromoszóma végén található ismétlődések, amelyek elengedhetetlenek a kromoszóma védelméhez és a teljes DNS-replikációhoz.
A csontvelő immun-mediált T-sejtes pusztulása
-
- Gyógyszerek, vegyi anyagok, vírusok és különböző mutációk megváltoztatják a HSC-k immunológiai megjelenését, ami a csontvelősejtek autoimmun pusztulásához vezet.
- A szerzett aplasztikus anémiában szenvedő betegeknél a limfociták felelősek a vérképző sejtek pusztulásáért.
- Ezek a T-sejtek gátló faktort, interferonokat , tumor nekrózis faktort és interleukin-2-t termelnek, ami a vérképző sejtek apoptózis általi pusztulásához vezet.
- AzCD4+CD25+FOXP3+ szabályozó T-sejtek hiányoznak ezekben a betegekben, hasonlóan ahhoz, ami más autoimmun állapotokban is megfigyelhető.
- Ezeknek a szabályozó T-sejteknek a hiánya a T-sejtek T-bet fehérjeszintjének növekedését, fokozott interferon (IFN)-γ,2 és őssejtpusztulást eredményez.
- A fokozott immunválasz, beleértve a tumor nekrózis faktor -α-t, az IFNγ-t és az interleukin-6-ot, szintén nagyon gyakori az AA betegeknél.
Klónális evolúció
- AAA fokozatosan más hematológiai rendellenességgé alakulhat, amelyek közé tartozik
-
- Paroxysmalis éjszakai hemoglobinuria
- Myelodiszpláziás szindrómák
- Akut myeloid leukémia
- Az AA klonális fejlődése mutációk vagy citogenetikai rendellenességek miatt következhet be.
- A leggyakrabban mutálódó gének a következők
- DMNT3A
- ASXL1
- BCOR
- BCORL1
- PIGA
.
Genetika
Az aplasztikus anémia patogenezisében szerepet játszó gének közé tartoznak:
- HLA-DR15
- CD4+ CD25+ FOXP3+ szabályozó T-sejtek
- STAT3
- TERT
- TERC
Társuló betegségek
A plasztikus anémia a következő betegségekkel társul:
- Fanconi-anémia
- PNH Paroxysmal Nocturnal Hemoglobinuria
Gross Pathology
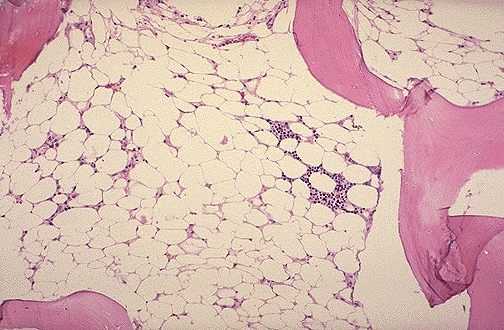
Aplastic anemia does nem mutat semmilyen durva patológiát
Mikroszkópos patológia
Aplasztikus anémiában a csontvelő mikroszkópos vizsgálata hipo-, sőt acellularitást mutat, zsírszövetet és halvány stromát.
- Hays K (1990. február). “A normális csontvelő élettana”. Semin Oncol Nurs. 6 (1): 3-8. PMID 2406826.
- Bacigalupo A (2007). “Aplasztikus anémia: patogenezis és kezelés”. Hematology Am Soc Hematol Educ Program: 23–8. doi:10.1182/asheducation-2007.1.23. PMID 18024605.
- 3.0 3.1 3.2 3.3 Brodsky, R. A. (2000). “Aplasztikus anémia: Pathophysiology and Treatment”. Journal of the National Cancer Institute. 92 (9): 754-754. doi:10.1093/jnci/92.9.754. doi:10.1093/jnci/92.9.754. ISSN 1460-2105.
- 4.0 4.1 Young, Neal S. (2002). “Acquired Aplastic Anemia”. Annals of Internal Medicine. 136 (7): 534. doi:10.7326/0003-4819-136-7-200204020-00011. ISSN 0003-4819.