Biologia per i maggiori I
Classifica i diversi tipi di legami atomici
Quando gli atomi si legano insieme, creano elementi. I diversi tipi di legami (ionici e covalenti, polari e non polari) hanno un impatto sugli elementi che creano. Capire i tipi di legami che creano le cose può aiutarci a capire le cose stesse.
Obiettivi di apprendimento
- Descrivere le caratteristiche dei legami ionici e identificare gli ioni comuni
- Descrivere le caratteristiche dei legami covalenti e distinguere tra legami polari e nonpolari
- Modella un legame idrogeno e identifica le sue qualità uniche
Legami ionici
Alcuni atomi sono più stabili quando guadagnano o perdono un elettrone (o forse due) e formano ioni. Questo riempie il loro guscio elettronico più esterno e li rende energeticamente più stabili. Poiché il numero di elettroni non è uguale al numero di protoni, ogni ione ha una carica netta. I cationi sono ioni positivi che si formano perdendo elettroni. Gli ioni negativi si formano guadagnando elettroni e sono chiamati anioni. Gli anioni sono designati dal loro nome elementare modificato per finire in “-ide”: l’anione del cloro è chiamato cloruro, e l’anione dello zolfo è chiamato solfuro, per esempio.
Questo movimento di elettroni da un elemento all’altro è chiamato trasferimento di elettroni. Come illustra la figura 1, il sodio (Na) ha solo un elettrone nel suo guscio elettronico esterno. Ci vuole meno energia per il sodio per donare quell’elettrone che per accettare altri sette elettroni per riempire il guscio esterno. Se il sodio perde un elettrone, ora ha 11 protoni, 11 neutroni e solo 10 elettroni, lasciandolo con una carica complessiva di +1. Ora è indicato come uno ione sodio. Il cloro (Cl) nel suo stato di energia più bassa (chiamato stato di terra) ha sette elettroni nel suo guscio esterno. Di nuovo, è più efficiente dal punto di vista energetico per il cloro guadagnare un elettrone che perderne sette. Pertanto, tende a guadagnare un elettrone per creare uno ione con 17 protoni, 17 neutroni e 18 elettroni, dandogli una carica netta negativa (-1). È ora indicato come uno ione cloruro. In questo esempio, il sodio donerà il suo unico elettrone per svuotare il suo guscio, e il cloro accetterà quell’elettrone per riempire il suo guscio. Entrambi gli ioni ora soddisfano la regola dell’ottetto e hanno gusci esterni completi. Poiché il numero di elettroni non è più uguale al numero di protoni, ognuno è ora uno ione e ha una carica di +1 (catione sodio) o -1 (anione cloruro). Si noti che queste transazioni possono normalmente avvenire solo simultaneamente: perché un atomo di sodio perda un elettrone, deve essere in presenza di un ricevente adatto come un atomo di cloro.
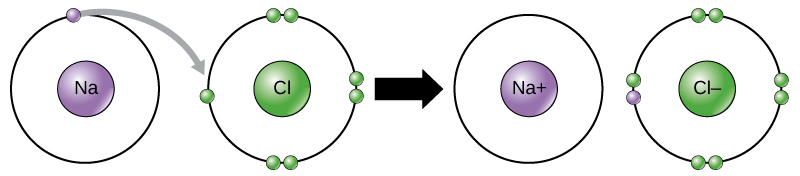
Figura 1. Nella formazione di un composto ionico, i metalli perdono elettroni e i non metalli guadagnano elettroni per ottenere un ottetto. I legami ionici si formano tra ioni con cariche opposte. Per esempio, ioni di sodio con carica positiva e ioni di cloruro con carica negativa si legano insieme per formare cristalli di cloruro di sodio, o sale da cucina, creando una molecola cristallina con carica netta zero.
I legami ionici si formano tra ioni con carica opposta. Per esempio, gli ioni di sodio con carica positiva e gli ioni di cloruro con carica negativa si legano insieme per formare cristalli di cloruro di sodio, o sale da cucina, creando una molecola cristallina con carica netta zero.
Alcuni sali sono indicati in fisiologia come elettroliti (inclusi sodio, potassio e calcio), ioni necessari per la conduzione degli impulsi nervosi, le contrazioni muscolari e l’equilibrio idrico. Molte bevande sportive e integratori alimentari forniscono questi ioni per sostituire quelli persi dal corpo attraverso la sudorazione durante l’esercizio fisico.
Video Review
Questo video mostra come i composti ionici si formano da anioni e cationi.
Legami covalenti
Un altro modo in cui la regola dell’ottetto può essere soddisfatta è la condivisione di elettroni tra atomi per formare legami covalenti. Questi legami sono molto più comuni dei legami ionici nelle molecole degli organismi viventi. I legami covalenti si trovano comunemente nelle molecole organiche basate sul carbonio, come il nostro DNA e le proteine. I legami covalenti si trovano anche in molecole inorganiche come H2O, CO2 e O2. Una, due o tre coppie di elettroni possono essere condivise, creando rispettivamente legami singoli, doppi e tripli. Più legami covalenti ci sono tra due atomi, più forte è il loro legame. Così, i legami tripli sono i più forti.
La forza dei diversi livelli di legame covalente è uno dei motivi principali per cui gli organismi viventi hanno difficoltà ad acquisire l’azoto da usare nella costruzione delle loro molecole, anche se l’azoto molecolare, N2, è il gas più abbondante nell’atmosfera. L’azoto molecolare è composto da due atomi di azoto legati in modo triplo tra loro e, come in tutte le molecole, la condivisione di queste tre coppie di elettroni tra i due atomi di azoto permette il riempimento dei loro gusci elettronici esterni, rendendo la molecola più stabile dei singoli atomi di azoto. Questo forte triplo legame rende difficile per i sistemi viventi scindere questo azoto per usarlo come costituente delle proteine e del DNA.
La formazione delle molecole d’acqua fornisce un esempio di legame covalente. Gli atomi di idrogeno e di ossigeno che si combinano per formare le molecole d’acqua sono legati insieme da legami covalenti. L’elettrone dell’idrogeno si divide tra il guscio esterno incompleto degli atomi di idrogeno e il guscio esterno incompleto degli atomi di ossigeno. Per riempire completamente il guscio esterno dell’ossigeno, che ha sei elettroni nel suo guscio esterno ma che sarebbe più stabile con otto, sono necessari due elettroni (uno da ogni atomo di idrogeno): da qui la nota formula H2O. Gli elettroni sono condivisi tra i due elementi per riempire il guscio esterno di ciascuno, rendendo entrambi gli elementi più stabili.
Guarda questo breve video per vedere un’animazione del legame ionico e covalente.
Legami covalenti polari
Ci sono due tipi di legame covalente: polare e non polare. In un legame covalente polare, mostrato nella figura 2, gli elettroni sono condivisi in modo ineguale dagli atomi e sono attratti più da un nucleo che dall’altro. A causa della distribuzione ineguale degli elettroni tra gli atomi di elementi diversi, si sviluppa una carica leggermente positiva (δ+) o leggermente negativa (δ-). Questa carica parziale è una proprietà importante dell’acqua e spiega molte delle sue caratteristiche.
L’acqua è una molecola polare, con gli atomi di idrogeno che acquisiscono una parziale carica positiva e l’ossigeno una parziale carica negativa. Questo accade perché il nucleo dell’atomo di ossigeno è più attraente per gli elettroni degli atomi di idrogeno che il nucleo dell’idrogeno per gli elettroni dell’ossigeno. Così l’ossigeno ha un’elettronegatività più alta dell’idrogeno e gli elettroni condivisi passano più tempo in prossimità del nucleo dell’ossigeno che non vicino al nucleo degli atomi di idrogeno, dando agli atomi di ossigeno e idrogeno cariche leggermente negative e positive, rispettivamente. Un altro modo di dire questo è che la probabilità di trovare un elettrone condiviso vicino a un nucleo di ossigeno è più probabile che trovarlo vicino a un nucleo di idrogeno. In entrambi i casi, l’elettronegatività relativa dell’atomo contribuisce allo sviluppo di cariche parziali ogni volta che un elemento è significativamente più elettronegativo dell’altro, e le cariche generate da questi legami polari possono poi essere utilizzate per la formazione di legami a idrogeno basati sull’attrazione di cariche parziali opposte. (I legami a idrogeno, che sono discussi in dettaglio più avanti, sono legami deboli tra atomi di idrogeno leggermente caricati positivamente e atomi leggermente caricati negativamente in altre molecole). Poiché le macromolecole hanno spesso atomi al loro interno che differiscono per elettronegatività, i legami polari sono spesso presenti nelle molecole organiche.
Legami covalenti non polari

Figura 2. Se una molecola è polare o non polare dipende sia dal tipo di legame che dalla forma molecolare. Sia l’acqua che l’anidride carbonica hanno legami covalenti polari, ma l’anidride carbonica è lineare, quindi le cariche parziali sulla molecola si annullano a vicenda.
I legami covalenti non polari si formano tra due atomi dello stesso elemento o tra elementi diversi che condividono equamente gli elettroni. Per esempio, l’ossigeno molecolare (O2) è non polare perché gli elettroni saranno equamente distribuiti tra i due atomi di ossigeno.
Un altro esempio di legame covalente non polare è il metano (CH4), mostrato anche nella figura 2. Il carbonio ha quattro elettroni nel suo guscio più esterno e ha bisogno di altri quattro per riempirlo. Ottiene questi quattro da quattro atomi di idrogeno, ogni atomo ne fornisce uno, creando un guscio esterno stabile di otto elettroni. Il carbonio e l’idrogeno non hanno la stessa elettronegatività, ma sono simili, quindi si formano legami non polari. Gli atomi di idrogeno hanno bisogno ciascuno di un elettrone per il loro guscio più esterno, che viene riempito quando contiene due elettroni. Questi elementi condividono equamente gli elettroni tra i carboni e gli atomi di idrogeno, creando una molecola covalente non polare.
Guarda questo video per un’altra spiegazione dei legami covalenti e di come si formano:
Legami idrogeno
I legami ionici e covalenti tra elementi richiedono energia per essere spezzati. I legami ionici non sono così forti come quelli covalenti, il che determina il loro comportamento nei sistemi biologici. Tuttavia, non tutti i legami sono ionici o covalenti. Legami più deboli possono formarsi anche tra le molecole. Due legami deboli che si verificano frequentemente sono i legami a idrogeno e le interazioni di van der Waals. Senza questi due tipi di legami, la vita come la conosciamo non esisterebbe. I legami a idrogeno forniscono molte delle proprietà critiche e vitali dell’acqua e stabilizzano anche le strutture delle proteine e del DNA, l’elemento costitutivo delle cellule.
Quando si formano legami covalenti polari contenenti idrogeno, l’idrogeno in quel legame ha una carica leggermente positiva perché l’elettrone dell’idrogeno è tirato più fortemente verso l’altro elemento e lontano dall’idrogeno. Poiché l’idrogeno è leggermente positivo, sarà attratto dalle cariche negative vicine. Quando questo accade, si verifica una debole interazione tra il δ+ dell’idrogeno di una molecola e la carica δ- sugli atomi più elettronegativi di un’altra molecola, di solito ossigeno o azoto, o all’interno della stessa molecola. Questa interazione è chiamata legame a idrogeno. Questo tipo di legame è comune e si verifica regolarmente tra le molecole d’acqua. I singoli legami a idrogeno sono deboli e si rompono facilmente; tuttavia, si verificano in gran numero nell’acqua e nei polimeri organici, creando una grande forza di combinazione. I legami a idrogeno sono anche responsabili della formazione della doppia elica del DNA.
Verifica la tua comprensione
Rispondi alla domanda(e) qui sotto per vedere quanto hai capito gli argomenti trattati nella sezione precedente. Questo breve quiz non conta per il tuo voto in classe, e puoi ripeterlo un numero illimitato di volte.
Utilizza questo quiz per verificare la tua comprensione e decidere se (1) studiare ulteriormente la sezione precedente o (2) passare alla sezione successiva.