Frontiers in Systems Neuroscience
I cambiamenti di stato del cervello sono associati a cambiamenti di microcircuito nelle proprietà di sparo dei neuroni e a cambiamenti a livello macro nei modelli sincroni o asincroni di attivazione del cervello. In questo quadro, gli assoni sono stati relativamente meno indagati (Barry, 2015), e poi principalmente nel contesto della velocità di conduzione dei potenziali d’azione e l’aumento della vigilanza che può derivare da cambiamenti nella velocità di conduzione (ad esempio, Stoelzel et al., 2017). Inoltre, tuttavia, la topologia altamente ramificata di molti assoni sembra ben progettata per reclutare in modo differenziato gruppi neuronali postsinaptici distribuiti, possibilmente in modo dipendente dallo stato. L’elaborazione del segnale può essere effettuata in almeno tre domini assonali: mappatura, amplificazione e temporizzazione (Innocenti et al., 2016; Innocenti, 2017). In questa prospettiva, discuto brevemente in primo luogo, esempi di rete di collateralizzazione assonale, e poi alcune delle caratteristiche intrinseche dell’assone che potrebbero essere alla base del reclutamento postsinaptico differenziale. Mancando parametri o meccanismi dettagliati, l’obiettivo è principalmente quello di evidenziare le caratteristiche generali che potrebbero figurare nel controllo e nelle transizioni degli stati cerebrali.
- Collateralizzazione assonale
- Collateralizzazione non stereotipata
- Collaterali intrinseci
- Un esempio interessante: Le cellule di Meynert nell’area V1 dei primati non umani
- Significato funzionale della ramificazione degli assoni
- Proprietà dinamiche degli assoni
- Conclusione
- Contributi dell’autore
- Finanziamento
- Conflict of Interest Statement
Collateralizzazione assonale
Tutti gli assoni hanno un’elaborata arborizzazione distale nella struttura di destinazione. Molti assoni, inoltre, hanno rami multipli (detti collaterali) che hanno come obiettivo strutture distintamente diverse (rivisto in Rockland, 2013, 2018). Un primo esempio è la ramificazione degli assoni dai neuroni corticotalamici dello strato 5. Questo è stato ripetutamente documentato ed è spesso discusso come un meccanismo chiave attraverso il quale un organismo può distinguere se i cambiamenti nell’input sensoriale sono prodotti da cambiamenti nell’ambiente o da movimenti auto-iniziati (“copia di efferenza” o “scarico collaterale”, Guillery e Sherman, 2011).
Nei roditori, dove c’è un gran numero di tecniche applicabili per studiare questo problema, la collateralizzazione è nota per essere relativamente comune. Per dare diversi esempi: (1) i neuroni del subiculum ippocampale proiettano ai corpi mammillari, alla corteccia retrospleniale, o tramite collaterale a entrambi (ratto: Kinnavane et al, 2018); (2) i neuroni serotoninergici del nucleo del rafe dorsale (DR) contattano in varie combinazioni lo striato, la corteccia prefrontale e l’amigdala (ratto: Gagnon e Parent, 2014) nonché combinazioni di nuclei autonomi (Waselus et al., 2011). In questo caso, l’attivazione della risposta allo stress da parte dei collateri DR potrebbe ottenere l’attivazione sincronizzata dei nuclei associati con il rilascio di neuro-ormoni o risposte pressorie. Le attivazioni differenziali e coordinate delle strutture del proencefalo possono contribuire alle funzioni multiformi ma correlate del DR, come la regolazione del ciclo sonno-veglia, la modulazione dei segnali del dolore o l’espressione dell’umore (Gagnon e Parent, 2014).
In terzo luogo, gli studi anatomici delle proiezioni talamocorticali del topo identificano “assoni multispecifici” che si ramificano ampiamente in domini ristretti in aree corticali (e sottocorticali) separate. Questi sono stati ipotizzati per orchestrare la rapida emergenza e riconfigurazione di assemblee neurali spazialmente distribuite e sincronizzabili (Clasca et al., 2016).
In quarto luogo, un recente studio delle connessioni corticocorticali utilizzando il tracciamento assonale whole-brain nella corteccia visiva del topo ha trovato che 23 dei 30 neuroni contattati da due a sette altre aree corticali. A conferma di questo risultato, il sequenziamento ad alta velocità del DNA di neuroni geneticamente codificati ha trovato il 44% di 533 neuroni a proiezione multipla (“broadcast neurons”, Han et al., 2018). Han et al. hanno provvisoriamente distinto due grandi tipi di neuroni proiettanti, una più piccola sottopopolazione “dedicata” (uni-target), coesistente con una prevalenza di cellule “broadcasting” (multiply projecting). Questa architettura potrebbe servire alle modulazioni dello stato cognitivo e dell’elaborazione sensoriale?
Collateralizzazione non stereotipata
Come osservato sopra, i neuroni che collateralizzano lo fanno secondo un modello non stereotipato. All’interno di una proiezione designata (definita dall’origine), i neuroni inviano rami a un sottoinsieme diversificato di aree bersaglio (“in tutte le combinazioni”). Questa osservazione è così coerente che può essere considerata una regola, anche se i parametri dettagliati non sono stati tabulati. Anche il significato funzionale non è chiaro, ma i risultati emergenti suggeriscono che gli input eterogenei e variabili a un neurone corticale (e, per estensione, potremmo dedurre agli assemblaggi neurali) sono importanti nel guidare la variabilità e i cambiamenti del treno di spike attraverso le prove sperimentali (Gomez-Laberge et al, 2016 e vedi sotto).
Collaterali intrinseci
In tutte le specie, i neuroni di proiezione corticale a lunga distanza, oltre a obiettivi estrinseci singoli o multipli, hanno tipicamente un’elaborata arborizzazione intrinseca. Alcuni neuroni corticali hanno solo una collateralizzazione intrinseca (locale), e alcuni solo una estrinseca (ratto: Kita e Kita, 2012). Anche se ci sono solo pochi dati per le proporzioni effettive di arborizzazioni intrinseche ed estrinseche (Parent et al., 2000; Rockland, 2018), le prove suggeriscono che questo sarà altamente variabile. Anche all’interno del sistema di connessioni intrinseche, non solo ci sono differenze nel numero di collaterali e nel numero di bouton sinaptici, ma un singolo neurone può avere un mix di collaterali mielinizzati e non mielinizzati (corteccia visiva di gatto: Martin et al., 2014; Koestinger et al., 2017). La mielinizzazione specifica del ramo potrebbe risultare in un aumento della velocità di conduzione specifica del ramo, anche se Koestinger et al. suggeriscono che potrebbe avere più a che fare con fattori come una maggiore sicurezza della trasmissione, presumibilmente, di nuovo, specifica del ramo.
Una curiosa osservazione relativa alla mielinizzazione riguarda la stria di Gennari, la banda di assoni mielinizzati nello strato 4B dell’area V1 dei primati. Dato che questa consiste di collateri intrinseci, la spiegazione comune, che la mielinizzazione è un mezzo per aumentare la velocità di conduzione sulle lunghe distanze, non è immediatamente applicabile. I collaterali locali non hanno bisogno (?) di un aumento in relazione agli obiettivi lontani e infatti, per la sincronicità che si sarebbe potuta prevedere, una conduzione locale migliorata (tramite la mielinizzazione?) sembra paradossale. Potrebbe essere che la mielinizzazione si riferisca ad altri fattori, come i cambiamenti legati alla plasticità (o allo stato) del diametro degli assoni?
Un esempio interessante: Le cellule di Meynert nell’area V1 dei primati non umani
Questi grandi neuroni, al confine degli strati 5 e 6, proiettano variamente all’area extrastriata MT, e/o ad altre aree di associazione visiva, e/o al nucleo pulvinare, e/o al collicolo superiore e al pretetto (Weisenhorn et al., 1995; Rockland e Knutson, 2001). La collateralizzazione intrinseca è eccezionalmente estesa, misurata come 8,0 mm dal soma, sulla base di ricostruzioni subtotali, e avendo almeno 800-1.370 bouton (Figura 1). Attraverso l’arborizzazione assonale, sembra esserci una variabilità distinta nel diametro del ramo, cioè, i rami estrinseci diretti all’area MT sono grandi (diametro ~ 3.0 μm), ma i rami intrinseci e quelli che proiettano al pulvinar e collicolo superiore appaiono più piccoli, come giudicato dalla microscopia ottica (cfr. Figura 1B (intrinseco) e Figura 1D (estrinseco alla zona MT). Diversi diametri presumibilmente indicano differenze nel grado di mielinizzazione e, di conseguenza, nella velocità di conduzione.
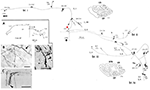
Figura 1. Una tipica arborizzazione assonale prossimale spazialmente estesa di una cellula di Meynert (asterisco rosso) nella corteccia visiva primaria di una scimmia macaco. Ci sono tre principali collateriali intrinseci (etichettati come br. i, ii, iv), che si estende 3,0 mm dorsale nello strato 1, 3,0 mm ventrale nello strato 6, 4,0 mm ventrale nello strato 6, e 0,5 mm nello strato 4B, come indicato dalle punte di freccia nei due contorni sezione coronale (sezioni 222 e 274, dove dorsale è a sinistra). Tutti insieme, i collateri intrinseci si estendono 5,9 mm anteriormente-posteriormente (117 sezioni × 50 μm). Un ulteriore, collaterale estrinseco (br. iii) si verifica negli strati 4 e 6 della zona V2. Porzioni dei singoli collateri e dell’assone principale (freccia spessa) non poteva essere seguito, come è indicato dalle linee tratteggiate. L’inserto a basso ingrandimento (A, a sinistra) fornisce una panoramica schematica della configurazione generale. I numeri indicano le singole sezioni, dove 20 numeri = 1.0 mm. Tutti i rami hanno numerosi piccoli cluster sinaptici, uno dei quali è illustrato in (B). Si noti la diminuzione del diametro tra l’assone principale (freccia) e l’arborizzazione terminale. Assoni estrinseci (C) sono di diametro variabile (un assone di grande diametro a punta di freccia). (D) terminazioni estrinseche nella zona MT includono alcuni assoni di grande diametro. Barra della scala = 25 μm in (B), 100 μm in (C), 20μm in (D). CF, fessura calcarina; LS, solco lunato; STS, solco temporale superiore; L, strato. Modificato dalle figure 1, 9 di Rockland e Knutson (2001) e dalle figure 6f, 7b di Rockland (1995) con l’autorizzazione.
Significato funzionale della ramificazione degli assoni
Una componente importante della collateralizzazione è che i rami figli non sono spesso uniformi, ma soprattutto nei punti di ramificazione, variano di diametro (Figura 2). La variabilità del diametro insieme ad altri parametri avrà un impatto sull’eccitabilità, la velocità di conduzione e altri aspetti della propagazione del segnale. Altri parametri di impatto includono la larghezza della mielina e la lunghezza intermodale, e la densità e la distribuzione dei canali ionici (rivisto in Debanne et al., 2011; Seidl, 2014; Bucher, 2016; Seidl e Rubel, 2016; Rama et al., 2018). Questi avrebbero effetti sulle proprietà di risposta neurale a livello di microcircuito. A livello più globale, l’attività sommata di più assoni proiettati, con diverse velocità di conduzione attraverso una rete interconnessa, potrebbe risultare in uno spettro di attivazioni sincrone e/o asincrone (Mitra et al., 2015; Zeki, 2016). Il reclutamento differenziale delle popolazioni postsinaptiche o le ricombinazioni della rete potrebbero essere fattori di transizioni di stato o di modulazione.
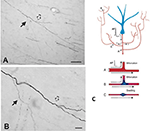
Figura 2. Un segmento di assone tipicamente ramificato nella materia bianca (scimmia macaco). Il segmento ha origine da un neurone nella corteccia parietale ed è visto qui nelle vicinanze della corteccia temporale ventrale. Pannello (A) è un ingrandimento inferiore di (B). Notate le doppie biforcazioni, dove il primo ramo figlio (freccia solida) è vistosamente più sottile (e non mielinizzato?) dell’assone principale. Nel secondo, leggermente più distale biforcazione (freccia cava), i rami figlia appaiono circa lo stesso diametro, ma entrambi sono più sottili dell’assone principale. Scale bar = 100 μm (A) e 10 μm (B). Riprodotto da Zhong e Rockland (2003) con il permesso. (C) Schema di un neurone (blu) e la sua topologia estesa ramificazione (scorciatoia per il bene di formattazione conveniente). Un potenziale d’azione (AP) può seguire percorsi circolari (A-C) verso obiettivi multipli. L’affidabilità della propagazione dipende sia dalle proprietà elettriche attive dell’assone che dalla sua geometria, comprese le disomogeneità di membrana come i rigonfiamenti e i diametri incompatibili dei rami. Sotto: schema per illustrare la propagazione affidabile (A, con corrispondenza ottimale dell’impedenza tra i rami madre e figlia), e la propagazione rallentata o fallita (B, dove il ramo figlia ha un diametro allargato; C, dove c’è un rigonfiamento di membrana interposto). Riprodotto da Huguenard (2000) con permesso.
La geometria dell’assone, le proprietà elettriche attive e le disomogeneità di membrana nei punti dei rami sono ben note come fattori di propagazione affidabile (ad esempio, Manor et al., 1991; Innocenti et al., 1994; Tettoni et al., 1998; Huguenard, 2000; Ofer et al., 2017). Questo porta a diversi scenari sulle caratteristiche temporali conseguenti alla collateralizzazione.
In primo luogo, ci può essere un’attivazione sincrona in tutti i rami figli. Le vie uditive del tronco encefalico proiettano attraverso un singolo assone biforcuto a bersagli ipsi- e controlaterali (rispettivamente, vie fisiche brevi e più lunghe). La trasmissione isocrona è ottenuta grazie alla mielinizzazione differenziale e al calibro degli assoni delle due filiali (cioè, calibro più piccolo e lunghezze intermodali più corte ipsilateralmente; Seidl, 2014; Seidl e Rubel, 2016). Poiché la maggior parte degli assoni ramificati, rispetto alle vie uditive del tronco encefalico, coprono un territorio più ampio e servono funzioni meno ben definite, i dati sono in gran parte incompleti o mancanti per altri sistemi. Si potrebbe prevedere, tuttavia, nel caso della sincronicità, che i rami prossimali (cioè i collateri intrinseci di Meynert o di altre cellule piramidali) avrebbero specializzazioni anatomiche che portano a tempi di conduzione più lunghi, per compensare e corrispondere alle distanze più lunghe dei collateri estrinseci. Come notato sopra, questa semplice previsione non sembra tenere. Ulteriori indagini comporteranno il campionamento da assoni identificati su lunghe distanze, e non sarebbe facile da realizzare.
In secondo luogo, l’attivazione specifica del ramo può essere asincrona. Questo potrebbe essere dovuto a un fallimento selettivo della trasmissione e/o a tempi di conduzione asincroni attraverso l’albero assonico (Figura 2; Huguenard, 2000; Bucher, 2016). I modelli dei circuiti corticali descrivono stati distintivi di sincronia transitoria di breve durata che potrebbero modellare dinamicamente il flusso di informazioni (Palmigiano et al., 2017). Dati sperimentali comparabili sono largamente carenti per gli assoni a lunga distanza. La topologia collaterale delle proiezioni talamocorticali, tuttavia, fornisce un esempio evocativo di un modello di attivazione asincrona complicato, dipendente dall’attività e/o dallo stato.
L’attività corticale e talamocorticale è altamente dipendente dallo stato; e l’interazione degli input estrinseci presinaptici (specifici del ramo?) con le proprietà intrinseche di membrana e sinaptiche dei neuroni postsinaptici è considerata fondamentale per la generazione dell’attività ritmica (con “effetti ad ampio raggio dal potenziamento o blocco dell’elaborazione sensomotoria….”, McCormick et al, 2015).
La variabilità delle risposte corticali è paradossale poiché queste servono anche come substrati dell’esperienza sensoriale stabile. La variabilità neuronale è stata associata al grado di sincronia eterogenea attraverso l’input estrinseco; cioè, la stimolazione sensoriale o le condizioni comportamentali che aumentano l’omogeneità dell’input in una data area sono previste per ridurre anche la variabilità neuronale (Gomez-Laberge et al., 2016). Recenti discussioni sulle risposte del microcircuito hanno ipotizzato un ruolo di primo piano delle lievi variazioni o differenze di informazione: “Ma cosa succede se le differenze tra la connettività all’interno di coorti di cellule della stessa classe sono importanti per la funzione del circuito?” (Morgan e Lichtman, 2017).
Proprietà dinamiche degli assoni
Sono stati riportati cambiamenti nella latenza di risposta in relazione a diversi stati di allerta. Nel percorso corticotalamico, una maggiore allerta si traduce in una latenza di risposta significativamente ridotta. Questo e/o i cambiamenti nella frequenza di sparo degli impulsi in arrivo possono essere responsabili di un’affidabilità di risposta drammaticamente aumentata per la sottopopolazione (58%) di neuroni corticogenicolati visivamente reattivi (nei conigli: Stoelzel et al., 2017). Questi risultati si riferiscono a singoli assoni fisiologicamente identificati; ma si può ipotizzare una più ampia applicabilità a rami di assoni collateralizzati.
I processi in corso di sinaptogenesi e di turnover degli assoni distali sono stati dimostrati nella corteccia adulta (NHP: Stettler et al., 2006). Su scale temporali più brevi, la microscopia di super-risoluzione dell’ippocampo CA3 non mielinizzato con GFP in fette di cervello organotipico mostra che gli assoni si allargano gradualmente dopo attacchi di alta frequenza, un’osservazione confermata dalla registrazione elettrofisiologica (Chereau et al., 2017). Altri cambiamenti specifici dei rami saranno probabilmente scoperti; per esempio, le arborizzazioni terminali di assoni etichettati individualmente dal rafe dorsale hanno una percentuale specifica di bouton che contengono la proteina VGLUT3 (percentuale maggiore per i rami che terminano nello striato che nella corteccia motoria). Questo implica un meccanismo di traffico complesso e non uniforme attraverso i collateriali (Gagnon e Parent, 2014).
Conclusione
In questo articolo di Perspective, ho discusso la ramificazione degli assoni come rilevante per i cambiamenti di stato del cervello, con impatto effettuato tramite proprietà specifiche del ramo, reclutamento differenziale di insiemi postsinaptici, e modelli di sincronizzazione del cervello intero. Questo si basa su discussioni a lungo termine riguardanti le topologie di ramificazione assonale e come queste potrebbero modulare l’elaborazione delle informazioni attraverso i ritardi nella propagazione degli impulsi, il filtraggio differenziale specifico delle ramificazioni e l’eccitabilità dipendente dall’attività (per esempio, Segev e Schneidman, 1999). Con poche eccezioni, come la via uditiva del tronco encefalico, mancano ancora dati concreti sulle attivazioni sincrone e asincrone attraverso le filiali e su come queste relazioni temporali possano avere un impatto sulla risposta neuronale postsinaptica (ma, vedi Gomez-Laberge et al., 2016; Stoelzel et al., 2017). Così, una sfida continua è quella di chiarire le caratteristiche specifiche del ramo all’interno dei singoli assoni e gli effetti sugli insiemi postsinaptici. Il lavoro recente porta alla ribalta ulteriori domande sull’eterogeneità della rete, compreso il motivo per cui i neuroni di una singola area di origine proiettano in modo variabile verso uno o più bersagli in quello che viene ripetutamente descritto come “in tutte le combinazioni.”
Contributi dell’autore
L’autore conferma di essere l’unico collaboratore di questo lavoro e lo ha approvato per la pubblicazione.
Finanziamento
Si ringrazia il National Institutes of Health (NIH) per il sostegno finanziario: MH107456.
Conflict of Interest Statement
L’autore dichiara che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Barry, J. M. (2015). Attività assonale in vivo: considerazioni tecniche e implicazioni per l’esplorazione dei circuiti neurali in animali in movimento libero. Front. Neurosci. 9:153 doi: 10.3389/fnins.2015.00153
PubMed Abstract | CrossRef Full Text | Google Scholar
Gagnon, D., and Parent, M. (2014). Distribuzione og VGLUT3 in assoni altamente collateralizzato dal nucleo raphe dorsale del ratto come rivelato da ricostruzioni singolo-neurone. PLoS ONE 9:e87709. doi: 10.1371/journal.pone.0087709
CrossRef Full Text | Google Scholar
Kita, T., e Kita, H. (2012). Il nucleo subtalamico è uno dei siti di innervazione multipli per assoni corticofughi a lungo raggio: uno studio di tracciamento singolo assone nel ratto. J. Neurosci. 32, 5990-5999 doi: 10.1523/JNEUROSCI.5717-11
PubMed Abstract | CrossRef Full Text | Google Scholar