Het element beryllium — Berylliumatoom
Beryllium is een chemisch element in het periodiek systeem dat het symbool Be en atoomnummer 4 heeft. Beryllium is een giftig tweewaardig element, een staalgrijs, sterk, licht maar bros aardalkalimetaal, dat voornamelijk wordt gebruikt als verhardingsmiddel in legeringen (met name berylliumkoper).
|
lithium – beryllium – borium Be
|
|
| Algemeen | |
|---|---|
| Naam, Symbool, Nummer | Beryllium, Be, 4 |
| Serie | Alkalische aardmetalen |
| Groep, Periode, Blok | 2 (IIA), 2, s |
| Dichtheid, Hardheid | 1848 kg/m3, 5.5 |
| Uiterlijk | wit-grijs metaalachtig |
| Atomaire eigenschappen | |
| Atomair gewicht | 9.01218 amu |
| Atomaire radius | 112 pm |
| Covalente radius | 90 pm |
| van der Waals straal | onbekend |
| Elektronenconfiguratie | 2s2 |
| e- ’s per energieniveau | 2, 2 |
| Oxidatietoestanden (oxide) | 2 (amfoteer) |
| Kristalstructuur | Hexagonaal |
| Fysische eigenschappen | |
| Materiële toestand | vast (diamagnetisch) |
| Smeltpunt | 1551.15 K |
| kookpunt | 3243,15 K |
| molair volume | 4.85 ×10-6 m3/mol |
| Verdampingswarmte | 292,40 kJ/mol |
| Smeltingswarmte | 12.20 kJ/mol |
| Dampdruk | 4180 Pa |
| Snelheid van het geluid | 13000 m/s |
| Diversen | |
| Elektronegativiteit | 1.57 (Pauling-schaal) |
| Specifieke warmtecapaciteit | 1825 J/kg*K |
| Elektrisch geleidingsvermogen | 31.3 106/m ohm |
| Thermische geleidbaarheid | 201 W/m*K |
| 1e ionisatiepotentiaal | 899,5 kJ/mol |
| 2e ionisatiepotentiaal | 1757.1 kJ/mol |
| 3e ionisatiepotentiaal | 14848,7 kJ/mol |
| SI eenheden & STP worden gebruikt, tenzij anders vermeld. | |
Beryllium heeft een van de hoogste smeltpunten van de lichte metalen. De elasticiteitsmodulus van beryllium is ongeveer 1/3 groter dan die van staal. Het heeft een uitstekend warmtegeleidingsvermogen, is niet-magnetisch en bestand tegen aantasting door geconcentreerd salpeterzuur. Het is zeer doorlaatbaar voor röntgenstralen, en er komen neutronen vrij wanneer het wordt geraakt door alfadeeltjes, zoals van radium of polonium (ongeveer 30 neutronen/miljoen alfadeeltjes). Bij standaardtemperatuur en -druk is beryllium bestand tegen oxidatie bij blootstelling aan lucht (hoewel het vermogen om op glas te krassen waarschijnlijk te wijten is aan de vorming van een dunne laag van het oxide).
>
Toepassingen
- Beryllium wordt gebruikt als legeringsmiddel bij de productie van berylliumkoper. (Be heeft het vermogen om grote hoeveelheden warmte te absorberen.) Beryllium-koperlegeringen worden gebruikt in een grote verscheidenheid van toepassingen vanwege hun elektrische en thermische geleidbaarheid, hoge sterkte en hardheid, niet-magnetische eigenschappen, samen met goede weerstand tegen corrosie en vermoeidheid. Deze toepassingen omvatten het maken van: puntlaselektroden, veren, vonkvrij gereedschap en elektrische contacten.
- Dankzij hun stijfheid, lichte gewicht en dimensionale stabiliteit over een breed temperatuurbereik, worden zuivere berylliumsoorten en aluminium-beryllium metaalmatrixcomposieten ook gebruikt in de defensie- en ruimtevaartindustrie als lichtgewicht constructiematerialen in hoge-snelheidsvliegtuigen, raketten, ruimtevoertuigen en communicatiesatellieten.
- Dunne vellen beryllium folie worden gebruikt bij röntgendetectiediagnostiek om zichtbaar licht uit te filteren en alleen röntgenstraling te detecteren.
- Op het gebied van röntgenlithografie wordt beryllium gebruikt voor de reproductie van microscopisch kleine geïntegreerde schakelingen.
- Omdat het een lage thermische neutronenabsorptiedoorsnede heeft, gebruikt de kernenergie-industrie dit metaal in kernreactoren als neutronenreflector en moderator.
- Beryllium wordt ook gebruikt bij de vervaardiging van gyroscopen, diverse computerapparatuur, uurwerkveren en instrumenten waarbij een laag gewicht, stijfheid en dimensionale stabiliteit nodig zijn.
- Berylliumoxyde is nuttig voor vele toepassingen die een uitstekende warmtegeleider vereisen, met hoge sterkte en hardheid, met een zeer hoog smeltpunt, en die als een elektrische isolator fungeert.
- Berylliumverbindingen werden ooit gebruikt in fluorescentieverlichtingsbuizen, maar dit gebruik werd stopgezet wegens berylliosis bij de arbeiders die de buizen vervaardigden (zie hieronder).
Geschiedenis
De naam beryllium komt van het Griekse beryllos, beryl. Ooit werd beryllium glucinium (van het Griekse glykys, zoet) genoemd, vanwege de zoete smaak van zijn zouten. Dit element werd ontdekt door Louis Vauquelin in 1798 als het oxide in beryl en in smaragden. Friedrich Wöhler en A. A. Bussy isoleerden het metaal onafhankelijk van elkaar in 1828 door kalium te laten reageren op berylliumchloride.
Occurrence
Beryllium wordt gevonden in 30 verschillende mineralen, waarvan de belangrijkste bertrandiet, beryl, chrysoberyl, en fenaciet zijn. Edele vormen van beryl zijn aquamarijn en smaragd. De belangrijkste commerciële bronnen van beryllium en berylliumverbindingen zijn beryl en bertrandiet. Momenteel gebeurt de productie van dit metaal meestal door berylliumfluoride te reduceren met magnesiummetaal. Berylliummetaal kwam pas in 1957 gemakkelijk beschikbaar.
Isolatie
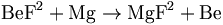
Isotopen
Beryllium heeft slechts één stabiele isotoop, Be-9. Kosmogeen beryllium (Be-10) wordt in de atmosfeer geproduceerd door de spallatie van zuurstof en stikstof door kosmische straling. Omdat beryllium de neiging heeft in oplossing te gaan bij pH-waarden van minder dan ongeveer 5,5 (en het meeste regenwater heeft een pH-waarde van minder dan 5), zal het in oplossing gaan en via regenwater naar het aardoppervlak worden getransporteerd. Als de neerslag snel alkalischer wordt, valt Be uit de oplossing. Cosmogeen Be-10 hoopt zich op aan het bodemoppervlak, waar het door zijn relatief lange halveringstijd (1,5 miljoen jaar) een lange verblijftijd heeft alvorens te vervallen tot B-10 (boor). Be-10 en zijn dochterproducten zijn gebruikt om bodemerosie, bodemvorming uit regolith, de ontwikkeling van lateritische bodems, alsmede variaties in zonneactiviteit en de ouderdom van ijskernen te onderzoeken.
Het feit dat Be-7 en Be-8 instabiel zijn heeft ingrijpende kosmologische gevolgen, omdat het betekent dat elementen zwaarder dan beryllium niet door kernfusie in de oerknal konden worden geproduceerd. Bovendien zijn de nucleaire energieniveaus van beryllium-8 zodanig dat koolstof in sterren kan worden geproduceerd, waardoor leven mogelijk wordt. (Zie triple-alpha proces en big bang nucleosynthese).
Voorzorgsmaatregelen

Berylliumerts
Beryllium en de zouten daarvan zijn giftige stoffen en mogelijk carcinogeen. Chronische berylliose is een pulmonale en systemische granulomateuze ziekte die wordt veroorzaakt door blootstelling aan beryllium. Acute berylliumziekte in de vorm van chemische pneumonitis werd voor het eerst gemeld in Europa in 1933 en in de Verenigde Staten in 1943. Gevallen van chronische berylliose werden voor het eerst beschreven in 1946 bij werknemers in fabrieken voor fluorescentielampen in Massachusetts. Chronische berylliosis lijkt in veel opzichten op sarcoïdosis, en de differentiële diagnose is vaak moeilijk.
Hoewel het gebruik van berylliumverbindingen in TL-buizen in 1949 werd gestaakt, bestaat het potentieel voor blootstelling aan beryllium in de nucleaire en ruimtevaartindustrie en bij de raffinage van berylliummetaal en het smelten van berylliumhoudende legeringen, de fabricage van elektronische apparaten, en de behandeling van ander berylliumhoudend materiaal.
Eerdere onderzoekers proefden beryllium en de verschillende verbindingen ervan op hun zoetheid om de aanwezigheid ervan te verifiëren. Moderne diagnostische apparatuur maakt deze zeer riskante procedure niet langer noodzakelijk en er moet geen poging worden gedaan om deze stof in te nemen. Beryllium en berylliumverbindingen moeten met grote zorg worden gehanteerd en er moeten speciale voorzorgsmaatregelen worden genomen bij het uitvoeren van werkzaamheden waarbij berylliumstof vrijkomt (longkanker is een mogelijk gevolg van langdurige blootstelling aan berylliumgeladen stof).
Deze stof kan veilig worden gehanteerd indien bepaalde procedures worden gevolgd. Er moet niet worden geprobeerd met beryllium te werken voordat men bekend is met de juiste hanteringsprocedures.
Gezondheidseffecten
Beryllium kan schadelijk zijn als u het inademt. De effecten hangen af van de hoeveelheid waaraan u wordt blootgesteld en de duur van de blootstelling. Als het berylliumgehalte in de lucht hoog genoeg is (meer dan 1000 ¼g/m³), kan een acute aandoening ontstaan. Deze aandoening lijkt op een longontsteking en wordt acute berylliumziekte genoemd. Normen voor beroeps- en omgevingslucht zijn effectief in het voorkomen van de meeste acute longschade.
Sommige mensen (1-15%) worden gevoelig voor beryllium. Deze personen kunnen een ontstekingsreactie in de ademhalingswegen ontwikkelen. Deze aandoening wordt chronische berylliumziekte (CBD) genoemd, en kan vele jaren na blootstelling aan hoger dan normale berylliumniveaus (meer dan 0,2 ¼g/m³) optreden. Deze ziekte kan ertoe leiden dat u zich zwak en moe voelt, en kan ademhalingsmoeilijkheden veroorzaken. Het kan ook leiden tot anorexia, gewichtsverlies, en in gevorderde gevallen ook tot hartvergroting aan de rechterkant en hartziekten. Sommige mensen die voor beryllium gesensibiliseerd zijn, hebben geen symptomen. Het is onwaarschijnlijk dat de algemene bevolking een acute of chronische berylliumziekte ontwikkelt, omdat de berylliumconcentraties in de lucht normaal gesproken zeer laag zijn (0,00003-0,0002 ¼g/m³).
Het inslikken van beryllium heeft bij mensen geen effecten veroorzaakt, omdat zeer weinig beryllium door maag en darmen wordt geabsorbeerd. Er zijn zweren waargenomen bij honden die beryllium via de voeding binnenkregen. Contact van beryllium met geschaafde of gesneden huid kan uitslag of zweren veroorzaken.
Lange blootstelling aan beryllium kan het risico op longkanker bij mensen verhogen.
Het Amerikaanse Ministerie van Volksgezondheid en Human Services (DHHS) en het Internationaal Agentschap voor Kankeronderzoek (IARC) hebben bepaald dat beryllium kankerverwekkend is voor de mens. Het U.S. Environmental Protection Agency (EPA) heeft bepaald dat beryllium een waarschijnlijk carcinogeen voor de mens is. De EPA heeft geschat dat levenslange blootstelling aan 0,04 ¼g/m³ beryllium kan resulteren in een kans van 1 op 1000 om kanker te ontwikkelen.
Er zijn geen studies over de gezondheidseffecten van kinderen die aan beryllium zijn blootgesteld. Het is waarschijnlijk dat de gezondheidseffecten bij kinderen die aan beryllium zijn blootgesteld, vergelijkbaar zullen zijn met de effecten bij volwassenen. We weten niet of kinderen anders dan volwassenen gevoelig zijn voor beryllium.
We weten niet of blootstelling aan beryllium zal leiden tot geboorteafwijkingen of andere ontwikkelingseffecten bij mensen. De studies naar ontwikkelingseffecten bij dieren zijn niet afdoende.
Beryllium kan worden gemeten in de urine en het bloed. De hoeveelheid beryllium in bloed of urine geeft mogelijk niet aan hoeveel of hoe recent u bent blootgesteld. Berylliumniveaus kunnen ook worden gemeten in long- en huidmonsters. Deze tests zijn meestal niet beschikbaar bij uw arts, maar uw arts kan de monsters opsturen naar een laboratorium dat de tests kan uitvoeren.
Een andere bloedtest, de bloed beryllium lymfocyten proliferatie test (BeLPT), identificeert beryllium sensibilisatie en heeft een voorspellende waarde voor CBD.
Typische berylliumniveaus die industrieën in de lucht kunnen brengen, liggen in de orde van grootte van 0,01 ¼g/m³, gemiddeld over een periode van 30 dagen, of 2 ¼g/m³ lucht in werkkamers gedurende een 8-urige werkploeg.