Salsola soda
De as verkregen door het verbranden van S. soda kan worden geraffineerd om een product te maken dat soda ash wordt genoemd, en dat een van de alkali materialen is die essentieel zijn voor het maken van soda-lime glas, zeep, en vele andere producten. Het belangrijkste actieve bestanddeel is natriumcarbonaat, waarmee de term “natriumcarbonaat” nu bijna synoniem is. De verwerkte as van S. soda bevat tot 30% natriumcarbonaat.
Een hoge concentratie natriumcarbonaat in de as van S. soda ontstaat als de plant wordt geteeld op zeer zoute gronden (d.w.z. op gronden met een hoge concentratie natriumchloride), zodat de weefsels van de plant een vrij hoge concentratie natriumionen bevatten. S. soda kan worden geïrrigeerd met zeewater, dat ongeveer 40 g/l opgelost natriumchloride en andere zouten bevat. Wanneer deze natriumrijke planten worden verbrand, reageert het kooldioxide dat daarbij vrijkomt vermoedelijk met dit natrium tot natriumcarbonaat.
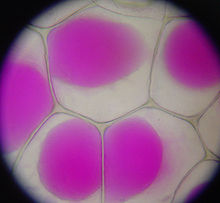
Het is verrassend dat in plantenweefsels een hogere concentratie natrium dan kalium wordt aangetroffen; het eerstgenoemde element is gewoonlijk giftig, terwijl het laatstgenoemde essentieel is voor de stofwisselingsprocessen van planten. De meeste planten, en vooral de meeste cultuurgewassen, zijn dus “glycofyten”, en lijden schade wanneer zij in zouthoudende bodems worden geplant. S. soda, en de andere planten die werden gekweekt voor natriumcarbonaat, zijn “halofyten” die veel meer zoute bodems verdragen dan glycofyten, en die kunnen gedijen met veel grotere dichtheden natrium in hun weefsels dan glycofyten.
De biochemische processen binnen de cellen van halofyten zijn doorgaans even gevoelig voor natrium als de processen in glycofyten. Natriumionen uit de bodem of het irrigatiewater van een plant zijn giftig, voornamelijk omdat zij interfereren met de biochemische processen in de cellen van een plant die kalium nodig hebben, een chemisch vergelijkbaar alkalimetaalelement. De cel van een halofyt zoals S. soda heeft een moleculair transportmechanisme dat natriumionen vasthoudt in een compartiment binnen de plantencel dat een “vacuole” wordt genoemd. De vacuole van een plantencel kan 80% van het volume van de cel innemen; het grootste deel van het natrium van een halofytencel kan in de vacuole worden afgezonderd, waardoor in de rest van de cel een aanvaardbare verhouding natrium-kaliumionen overblijft.
Naast S. soda is ook natriumcarbonaat geproduceerd uit de as van S. kali (een andere zoutminnende plant), van zeekraal, en van kelp, een soort zeewier. Het natriumcarbonaat, dat in water oplosbaar is, wordt uit de as “gelixiveerd” (met water geëxtraheerd), en de resulterende oplossing wordt drooggekookt om het eindproduct natriumcarbonaat te verkrijgen. Een soortgelijk proces wordt gebruikt om potas (hoofdzakelijk kaliumcarbonaat) te verkrijgen uit de as van hardhoutbomen. Omdat halofyten ook kaliumionen in hun weefsels moeten hebben, bevat zelfs het beste natriumcarbonaat dat van hen wordt verkregen ook wat kalium (kaliumcarbonaat), zoals in de 19e eeuw bekend was.
Planten waren tot het begin van de 19e eeuw een zeer belangrijke bron van natriumcarbonaat. In de 18e eeuw had Spanje een enorme industrie voor de produktie van barilla (een soort plantaardig natriumcarbonaat) uit zoutmoerasplanten. Ook Schotland kende in de 18e eeuw een grote industrie voor de produktie van natriumcarbonaat uit kelp; deze industrie was zo lucratief dat zij tot overbevolking leidde op de Western Isles van Schotland, en men schat dat 100.000 mensen zich in de zomermaanden met “kelping” bezighielden. De commercialisering van het Leblanc-procédé voor de synthese van natriumcarbonaat (uit zout, kalksteen en zwavelzuur) maakte in de eerste helft van de 19e eeuw een einde aan het tijdperk van de natriumcarbonaatteelt.

