Amfetaminy | Zaburzenia uzależniające
Pochodzenie amfetaminy
Amfetamina została po raz pierwszy zsyntetyzowana w 1887 r. przez L. Edelano. W 1920 r. Gordon Alles odkrył, że związek macierzysty, siarczan amfetaminy, oraz jego jeszcze bardziej aktywny dekstroizomer, siarczan dekstroamfetaminy, posiadają zdolność stymulowania ośrodkowego układu nerwowego (OUN). W 1931 r. laboratoria farmaceutyczne w Stanach Zjednoczonych rozpoczęły jej badania, a pięć lat później, w czasie prohibicji, Smith Kline & French, firma farmaceutyczna, która nabyła patenty Allesa, wprowadziła ją do praktyki medycznej pod nazwą handlową Benzedrine® (bennies dla bywalców). Niemal natychmiast na rynku pojawił się jej bardziej aktywny izomer, dekstroamfetamina sprzedawana pod nazwą Dexedrine® (dexies). Po wprowadzeniu ich do wykazu substancji kontrolowanych, oba rodzaje amfetaminy pojawiły się na amerykańskim czarnym rynku pod nazwami związanymi z ich subiektywnymi skutkami, takimi jak prędkość i uppers.
Struktura i klasyfikacja
Amfetaminy są aminami sympatykomimetycznymi, o strukturalnym wzorze chemicznym podobnym do adrenaliny (rys. 1). Dwie najczęściej stosowane amfetaminy, z których wywodzą się najnowocześniejsze leki z tej grupy, to: siarczan d-amfetaminy lub d-fenylo-izopropyloaminy (deksedryna), który odpowiada izomerowi dekstrorotacyjnemu tej substancji, oraz racemiczny siarczan amfetaminy (benzedryna) (ryc. 2). Związek dekstrotorotacyjny (deksedryna lub d-benzedryna) jest dwa razy bardziej aktywny niż związek racemiczny (benzedryna) i cztery razy bardziej aktywny niż związek leworotacyjny. Farmakologicznie, w miarę jak związek o budowie chemicznej zbliżonej do adrenaliny oddala się od adrenaliny w kierunku amfetamin, zwiększa swoją aktywność stymulującą OUN, a zmniejsza aktywność w obwodach organizmu (układ neurowegetatywny).
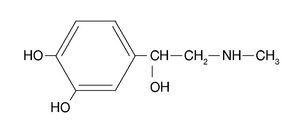
Rycina 1. Struktura chemiczna adrenaliny.
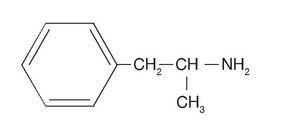
Rysunek 2. Struktura chemiczna dl-amfetaminy.
Najczęściej stosowane preparaty psychostymulujące z grupy amfetamin obejmują amfetaminę, fenterminę, chlorfenterminę i metamfetaminę (rys. 3), przy czym ta ostatnia ma duże znaczenie, ponieważ jest podstawą grupy MDMA (3,4-metylenodioksymetamfetaminy; ecstasy). Pojawił się również szereg związków należących do nieamfetaminowej grupy amin heterocyklicznych, otrzymywanych z kwasu piperdynowego, takich jak metylofenidat i pripadol. Inne aminy heterocykliczne obejmują facetoteran i fenmentracynę. Leki te są stosunkowo nowe, chociaż roślina, z której pozyskiwana jest efedryna (Catha edulis) była stosowana od czasów starożytnych w leczeniu astmy. Począwszy od lat 60. XX w. reklama przywróciła modę na używanie amfetaminy ze względu na jej właściwości hamujące apetyt (anorektyczne).
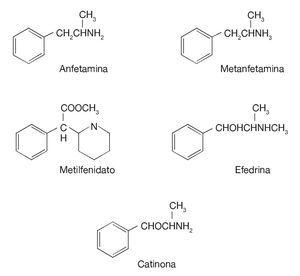
Rysunek 3. Struktura chemiczna amfetaminy i niektórych pochodnych.
Mechanizm działania
Amfetaminy mają mechanizm działania obejmujący kilka neuroprzekaźników, takich jak dopamina, serotonina, adrenalina i noradrenalina.
Zwiększone uwalnianie dopaminy
Zwiększone stężenie neuroprzekaźnika w przestrzeni synaptycznej występuje zarówno poprzez blokowanie wychwytu zwrotnego, w mechanizmie podobnym do mechanizmu działania kokainy, ale z innym punktem uchwytu, jak i poprzez zwiększone uwalnianie, ponieważ d-amfetamina może wnikać do neuronu i wypierać dopaminę z jej pozazwojowych magazynów cytoplazmatycznych (fig. 4), z następowym wyczerpaniem neuroprzekaźników1,2.
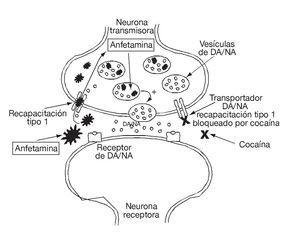
Rycina 4. Schemat mechanizmu działania amfetamin na dopaminergiczny i noradrenergiczny układ neuroprzekaźnikowy. DA: dopamina; NA: noradrenalina.
Ten wzrost dopaminy w obszarach bocznego podwzgórza dose-dependently reguluje apetyt sensation. Natomiast podwyższony poziom dopaminy w szlakach nigrostriatalnych i mezokortykolimbicznych (ryc. 5) ma związek z psychostymulującymi i nagradzającymi właściwościami amfetaminy.
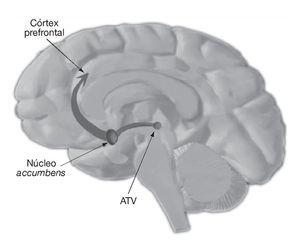
Rycina 5. VTA: ventral tegmental area.
Zahamowanie wychwytu zwrotnego serotoniny
Amfetamina zwiększa zewnątrzkomórkowe stężenie serotoniny3 poprzez wyparcie neuroprzekaźnika z jego specyficznego presynaptycznego transportera. Kiedy amfetamina wiąże się z transporterami serotoniny, zarówno zapobiega przedostawaniu się serotoniny do terminala, jak i odwraca mechanizm wychwytu zwrotnego, tak że serotonina wychodzi do przestrzeni synaptycznej. Mechanizm ten wydaje się bardziej selektywny dla leków takich jak fenfluramina i deksfenfluramina, które również uwalniają serotoninę z jej wewnątrzkomórkowych magazynów i są zdolne do aktywacji receptorów 5-HT1. Zwiększona ilość serotoniny jest również zaangażowana w efekt anorektyczny wywoływany przez amfetaminy.
Zwiększone uwalnianie noradrenaliny
Amfetaminy ułatwiają uwalnianie noradrenaliny poprzez transport do zakończeń nerwowych w mechanizmie wychwytu zwrotnego (rys. 4). W zakończeniach nerwowych są one pobierane przez transporter pęcherzykowy w zamian za noradrenalinę, która wydostaje się do cytozolu. Działają one tylko słabo na receptory adrenergiczne. Mechanizm ten częściowo wyjaśniałby ośrodkowe efekty amfetamin, takie jak zwiększona aktywność ruchowa, zmniejszone zmęczenie oraz efekty obwodowe, które towarzyszą tym lekom, takie jak tachykardia, pocenie się i trudności w oddawaniu moczu.
Zaburzenia funkcji pęcherzykowego transportera monoamin
Pęcherzykowy transporter monoamin (VMAT2) znajduje się głównie w OUN i jest odpowiedzialny za transport monoamin obecnych w cytoplazmie do pęcherzyków magazynujących. Amfetaminy mogą zaburzać gradient protonów w błonach tych pęcherzyków synaptycznych, a tym samym ich funkcję. W ten sposób odwracają strumień tych transporterów, prowadząc do zwiększenia cytoplazmatycznego stężenia noradrenaliny, dopaminy i serotoniny. Ponieważ VMAT2 może odgrywać rolę w stymulacji lokomotorycznej i właściwościach wzmacniających wywoływanych przez amfetaminy, może być celem dla rozwoju strategii terapeutycznych w procesach uzależnienia związanych z używaniem środków psychostymulujących4.
Farmakologiczne działanie amfetamin
Obwodowo
Amfetaminy powodują obwodowe zwężenie naczyń krwionośnych i w rezultacie wzrost zarówno skurczowego, jak i rozkurczowego ciśnienia krwi. Zwiększa częstość akcji serca poprzez działanie beta-adrenergiczne, choć może również odruchowo ją zmniejszać. Na poziomie mięśni gładkich kurczy mięsień promieniowy tęczówki, powodując mydriazę i wzrost ciśnienia wewnątrzgałkowego. Perystaltyka jest zmniejszona, podobnie jak wydzielanie. Rozluźnia mięśnie oskrzeli poprzez działanie beta-adrenergiczne. Obkurcza zwieracz pęcherza moczowego, przez co utrudnia oddawanie moczu.
Na poziomie ośrodkowego układu nerwowego
Amfetaminy wywołują uczucie czujności, pobudzenia, poprawę sprawności intelektualnej i wykonywania zadań manualnych, uczucie energii, zmniejszenie zmęczenia, snu i głodu. Mają one wysoki potencjał do nadużywania i mogą powodować uzależnienie. U zwierząt doświadczalnych amfetamina powoduje zależny od dawki wzrost aktywności lokomotorycznej, a w dużych dawkach wywołuje stereotypie. Zasugerowano, że u ludzi jedzenie w nadmiernych ilościach może być przejawem stereotypowego zachowania u zwierząt.
Tolerancja
Zarówno subiektywne, jak i obiektywne skutki ulegają zjawisku tolerancji po wielokrotnym stosowaniu amfetamin i ich pochodnych, tak że do osiągnięcia tego samego efektu wymagane są większe dawki.
Tolerancja ta może mieć charakter przewlekły lub ostry (tachyfilaksja). Proponowany mechanizm tolerancji lub desensytyzacji obejmuje fosforylację receptora, która powoduje rozłączenie pomiędzy białkiem G a samym receptorem5. Zarówno przewlekła, jak i ostra tolerancja są częściowo odpowiedzialne za tendencję do nadużywania pochodnych amfetaminy w pogoni za efektami pobudzającymi. Tachyfilaksja, z drugiej strony, może prowadzić do zagrażającego życiu przedawkowania. Tolerancję krzyżową między środkami sympatykomimetycznymi typu amfetaminy obserwowano klinicznie, a u szczurów wykazano tolerancję krzyżową między działaniem anorektycznym kokainy i amfetaminy. Ponadto opisano odwrotną tolerancję lub uczulenie, które są charakterystyczne dla używania pochodnych amfetaminy i objawiają się jako stan przedawkowania po spożyciu zwykłych dawek.
Uczulenie
Uczulenie behawioralne odnosi się do zwiększonej reakcji na amfetaminę po jej wielokrotnym podaniu. Obszar brzuszno-przyśrodkowy (VTA) został włączony do indukcji uwrażliwienia behawioralnego pod wpływem amfetaminy6. Przejawem sensytyzacji jest przypuszczalnie desensytyzacja presynaptycznych receptorów dopaminergicznych D2, które negatywnie modulują uwalnianie dopaminy w niektórych obszarach mózgu, takich jak jądro akomodacji. Tak więc podanie leku spowoduje dalszy wzrost synaptycznej dopaminy, co w konsekwencji zwiększy intensywność efektu. Uczulenie może być długotrwałe i wydaje się rozwijać szybciej, gdy lek jest podawany z przerwami. Ostatnio opisano inny mechanizm, który próbuje wyjaśnić uczulenie. Tak więc amfetaminy (d-amfetamina i fenfluramina) są w stanie wykorzystać presynaptyczny transporter dla serotoniny wypierając go, zapobiegając w ten sposób fosforylacji prowadzącej do wewnątrzkomórkowej dystrybucji serotoniny i zwiększając liczbę transporterów dostępnych w błonie dla kolejnych dawek leku. Ta redystrybucja białek wychwytu zwrotnego w błonie może reprezentować niektóre ze zmian molekularnych zaangażowanych w uwrażliwienie na działanie stymulantów. Uważa się, że zjawisko to jest odpowiedzialne za stany psychotyczne, które czasami towarzyszą stosowaniu tych leków.
Zależność
Amfetaminy są początkowo przyjmowane w pojedynczych dawkach i wywołują euforię i wzmocnienie (faza początkowa), głównie ze względu na ich zdolność do uwalniania dopaminy w zakończeniach dopaminergicznych w szlaku mezokortykolimbicznym (jądro akumbens i kora przedczołowa). Wraz ze wzrostem spożycia (faza konsolidacji) rozwija się tolerancja, którą można przezwyciężyć poprzez zwiększenie dawki lub zmianę drogi podania. Na tym etapie zaczyna się wyczerpywanie dopaminy. Tolerancja wzrasta i zaczyna się bingeing w celu utrzymania euforii. Binge trwa około 12-48 godzin i kończy się wyczerpaniem osoby badanej, która potrzebuje kilku dni, aby dojść do siebie. W tej fazie stężenie dopaminy jest bardzo niskie i może występować upośledzenie neuronów.
Ogólne kryteria nadużywania (używanie rzadsze niż uzależnienie) zawarte w Diagnostic and Statistical Manual of Mental Disorders IV (DSM-IV) dotyczą amfetamin i narkotyków syntetycznych. Obserwuje się u nich brak zgodności, używanie w sytuacjach ryzykownych oraz mogą mieć problemy prawne, społeczne i interpersonalne z powodu używania i jego konsekwencji.
Ogólne kryteria DSM-IV dotyczące uzależnienia od amfetaminy mają również zastosowanie do amfetamin. Uzależnieniu od amfetaminy towarzyszy intensywna tolerancja, odstawienie i wycofanie się ze zwykłych czynności. Pojawia się nieodparta potrzeba zażywania (głód). Podczas stosowania często występują objawy psychotyczne. Nagłe zaprzestanie przewlekłego używania amfetaminy charakteryzuje się wystąpieniem zespołu odstawienia o różnych fazach. Faza początkowa (crash) rozpoczyna się w ciągu kilku godzin i trwa do 9 dni. Pojawia się dysforia, depresja, anergia, pobudzenie, lęk, bezsenność, hipersomnolencja, hiperfagia i intensywne łaknienie. Faza pośrednia lub wycofania pojawia się między 1 a 10 tygodniem. Początkowo objawia się ona zmęczeniem, brakiem energii, anhedonią i depresją. Zmniejsza się łaknienie i jeśli nie dochodzi do nawrotu choroby, objawy depresyjne stopniowo się poprawiają. W trzeciej fazie, która jest nieokreślona, mogą pojawić się intensywne epizody głodu, zwykle związane z sygnałami warunkowymi, które mogą spowodować nawrót choroby. U osób, które spożyły duże dawki, mogą wystąpić myśli samobójcze. Podobny obraz został opisany w przypadku kokainy. Nie istnieje specyficzne farmakologiczne leczenie uzależnienia od amfetaminy. Ponieważ wydaje się, że może być spadek dopaminy podczas wycofania, dopaminy agonistów i leki przeciwdepresyjne zostały wykorzystane. Wyniki leczenia lekami psychotropowymi są rozczarowujące. Pomocna może okazać się psychoterapia. Zaburzenia wywołane amfetaminą leczy się objawowo, lekami przeciwpsychotycznymi w przypadku objawów psychotycznych, a anksjolitykami w przypadku lęku i napadów paniki lub zaburzeń panicznych. Skutki farmakologiczne metamfetaminy zostały ostatnio poddane przeglądowi7.
Nerotoksyczność metamfetaminy
Nerotoksyczność wywołana substancją jest definiowana jako szkodliwa strukturalna lub funkcjonalna zmiana w OUN. Dlatego też neurotoksyczność wywoływana przez amfetaminy zazwyczaj odnosi się do trwałych zmian na poziomie neurochemicznym i neuronalnym, w tym zmian w aksonach i zakończeniach zawierających monoaminy. U szczurów i małp podawanie metamfetaminy powoduje spadek stężenia dopaminy i jej metabolitów8. U szczurów metamfetamina zmniejsza również poziom serotoniny, miejsca wychwytu zwrotnego dopaminy i serotoniny, zmniejsza aktywność enzymów biorących udział w syntezie neuroprzekaźników (hydroksylazy tyrozynowej i/lub hydroksylazy tryptofanowej) oraz powoduje zmiany morfologiczne w neuronach9. Zmiany strukturalne w neuronach obserwowane są w aksonach i obejmują pojawienie się żylaków oraz zmniejszenie i zubożenie aksonów. Czynniki wpływające na rozwój neurotoksyczności metamfetaminy obejmują stosowane dawki, liczbę ekspozycji na narkotyk, odstępy między dawkami oraz czas ekspozycji neuronów na działanie narkotyku. Chociaż dane dotyczące ludzi są bardzo ograniczone, niektóre badania wskazują, że metamfetamina u ludzi może wywoływać trwałą neurotoksyczność dopaminergiczną związaną ze zmianami czynnościowymi, ale obserwowano również pewną regenerację uszkodzonych neuronów kilka miesięcy po zaprzestaniu używania narkotyku10.
Badania neurobiologiczne u zwierząt laboratoryjnych
Wpływ na aktywność lokomotoryczną
Amfetaminy wywołują stymulację ośrodkową11 , termin używany do opisania ich wpływu na aktywność lokomotoryczną u zwierząt oraz na sen i aktywność elektroencefalograficzną. Początkowo amfetamina wywołuje stan czujności, któremu towarzyszy wzrost zachowań eksploracyjnych, uwodzenia, pionowej i poziomej lokomocji, po czym następuje spadek tych aktywności na rzecz zachowań stereotypowych (odpowiedź na dawkę w kształcie odwróconej litery U). Badania neuroanatomiczne wykazują, że wzrost aktywności lokomotorycznej wywołany przez amfetaminę jest zależny od nigrostriatalnego i mezolimbicznego układu dopaminergicznego. Ponadto, ośrodkowe uwalnianie noradrenaliny może mieć znaczenie w hiperlokomocji. Z drugiej strony, stereotypie wydają się być wywoływane przez uwalnianie nowo syntetyzowanej dopaminy w nigrostriatalnej i mezolimbicznej ścieżce dopaminergicznej i są regulowane przez równowagę między układem dopaminergicznym i cholinergicznym.
Wpływ na zachowania agresywne
Wpływ amfetaminy na zachowania agresywne u zwierząt jest złożony i zależy od podawanej dawki oraz stosowanego paradygmatu doświadczalnego. Ważna jest również rola czynników środowiskowych i uwarunkowań genetycznych w tych efektach. Zarówno u zwierząt, jak i u ludzi, amfetamina może wywoływać epizody skrajnej agresji, jak również wycofanie się z wszelkiej wymiany społecznej. Mechanizmy neurobiologiczne zaangażowane w wieloraki wpływ amfetaminy na zachowania agresywne zostały powiązane z mechanizmami związanymi z jej właściwościami psychostymulującymi. Jednym z paradygmatów wykorzystywanych do badania wpływu tych substancji na zachowania agresywne jest test intruza. Test ten obejmuje konfrontacje pomiędzy zwierzęciem zamieszkującym a intruzem i bada biologicznie uzasadnione zachowania, takie jak uległość, zachowania obronne, atak i ucieczka. Wykazano zatem, że amfetamina zwiększa zachowania obronne i ucieczkowe w różnych warunkach doświadczalnych i u różnych gatunków zwierząt, a efekt ten nie wydaje się być wywoływany przez ośrodkowy układ dopaminergiczny. Jednakże antagoniści dopaminy odwracają nasilające się skutki zachowań agresywnych wywołane przez ostre podawanie małych dawek amfetaminy.12
Wpływ na uczenie się
Większość badań na zwierzętach sugeruje, że amfetamina nie zakłóca uczenia się, a w niektórych warunkach może je nawet nasilać. Istnieją jednak również dane wskazujące na szkodliwe skutki13. Wiadomo, że uczenie się pod wpływem amfetaminy jest lepiej zapamiętywane, jeśli w dniu badania podawana jest amfetamina, a nie sól fizjologiczna. Ponadto podczas odstawienia amfetaminy pojawiają się zaburzenia zachowań wyuczonych pod wpływem amfetaminy. Wykazano więc, że stan wewnętrzny wywołany przez amfetaminę u zwierzęcia wpływa na uczenie się zadań wyuczonych pod wpływem amfetaminy (uczenie zależne od stanu). Ten wewnętrzny stan służy jako bodziec dyskryminacyjny. Badania neurofarmakologiczne wykazują, że w stanie wywołanym przez amfetaminę pośredniczy dopaminergiczny układ neuroprzekaźnikowy na poziomie szlaku mezolimbicznego. Co ważne, właściwości dyskryminacyjne amfetaminy nie były związane z jej działaniem psychostymulującym14.
Pozytywne efekty wzmacniające
Do oceny „nagradzających” efektów amfetaminy wykorzystywano technikę samostymulacji domózgowej. Opiera się to na fakcie, że elektryczna stymulacja pewnych obszarów mózgu wywołuje przyjemne doznania. Wspólną właściwością narkotyków nadużywanych jest ułatwianie stymulacji elektrycznej tych ośrodków ze względu na ich właściwości euforyzujące. Amfetamina powoduje wzrost samostymulacji wewnątrzczaszkowej i obniżenie progu prądu niezbędnego do utrzymania tego zachowania15. Mechanizm neurochemiczny zaangażowany w ten efekt wydaje się być interakcją pomiędzy centralnym uwalnianiem dopaminy i noradrenaliny16. Z drugiej strony, wiele badań oceniających potencjał uzależniający narkotyków opiera się na ocenie ich właściwości wzmacniających, ponieważ to one w głównej mierze przyczyniają się do kompulsywnego poszukiwania i nadużywania narkotyków. Tak więc potencjał wzmacniający narkotyku, określony w paradygmacie dożylnego samopodawania narkotyków u zwierząt, jest najwyraźniejszym wskaźnikiem jego potencjału uzależniającego u ludzi. W tym względzie wykazano, że amfetamina wywołuje zachowania związane z samopodawaniem u szczurów17 i małp18 . Wydaje się, że amfetamina wywiera swoje właściwości wzmacniające poprzez działanie na mezolimbiczne neurony dopaminergiczne. Tak więc, obwodowe podanie amfetaminy zwiększa zewnątrzkomórkowe stężenie dopaminy w jądrze akumbens u szczurów2 , a zniszczenie terminali dopaminergicznych w jądrze akumbens blokuje samopodawanie amfetaminy. W kilku badaniach wykazano, że leczenie amfetaminą, które powoduje uwrażliwienie mezolimbicznych neuronów dopaminergicznych, zwiększa zachowania związane z poszukiwaniem substancji psychostymulujących i samopodawaniem19 . Wykazano również, że stymulacja receptorów kwasu gamma-aminomasłowego B (GABAB) przez obwodowe podawanie baklofenu zmniejsza samopodawanie amfetaminy i pozakomórkowe stężenie dopaminy w jądrze ogoniastym szczura20.
Skutki u ludzi
Subiektywne skutki
Podawanie głównych amfetamin u ludzi wywołuje skutki pobudzające, z uczuciem dobrego samopoczucia, euforii, energii, zmniejszonego zmęczenia i snu, uczuciem czujności, zwiększoną sprawnością intelektualną i psychomotoryczną oraz zmniejszonym łaknieniem. Działanie rozpoczyna się godzinę po podaniu, jest maksymalne w ciągu 1-3 godzin i może utrzymywać się do 8-12 godzin21. Kiedy przyjemne efekty ustąpią, może pojawić się uczucie „załamania”, z dysforią, zmęczeniem, przygnębieniem, depresją, drażliwością, bezsennością lub sennością. Zderzenia te są bardziej intensywne, jeżeli amfetamina była używana w dużych ilościach lub wielokrotnie. Często są one spożywane kompulsywnie (binge) przez jeden lub dwa dni, pozostawiając osobę w stanie fizycznego i psychicznego wyczerpania (comedown). Powrót do zdrowia może trwać kilka dni, aż do rozpoczęcia kolejnego nałogu.
Farmakokinetyka
Amfetamina jest szybko wchłaniana po spożyciu doustnym. Najwyższe stężenie w osoczu występuje w ciągu 1 do 3 godzin, w zależności od aktywności fizycznej i ilości pokarmu w żołądku. Całkowite wchłonięcie następuje zwykle po 4 do 6 godzinach od spożycia. Amfetaminy koncentrują się w nerkach, płucach, płynie mózgowo-rdzeniowym i mózgu. Są to substancje o wysokiej lipofilności, które łatwo przekraczają barierę krew-mózg. Prawidłowa objętość dystrybucji wynosi 5 l/kg masy ciała. W normalnych warunkach około 30% amfetaminy jest wydalane z moczem, nie będąc metabolizowane. Jednakże, wydalanie to zmienia się w zależności od pH moczu. Jeśli pH moczu jest kwaśne (pH 5,5-6,0), eliminacja odbywa się głównie poprzez wydalanie z moczem i prawie 60% wydalonej dawki nie jest zmieniana przez nerki. Jeśli pH jest zasadowe (pH 7,5-8,0), eliminacja odbywa się głównie poprzez deaminację i mniej niż 7% jest wydalane w postaci niezmienionej. Okres półtrwania waha się od 16 do 31 godzin. Główny szlak metaboliczny amfetaminy obejmuje jej deaminację przez cytochrom P450 w celu utworzenia para-hydroksyamfetaminy i fenyloacetonu. Ten ostatni związek jest utleniany do kwasu benzoesowego i wydalany sprzężony z kwasem glukuronowym lub glicyną. Niewielkie ilości amfetaminy są przekształcane do noradrenaliny w procesie utleniania. W wyniku hydroksylacji powstaje aktywny metabolit, O-hydroksynorepinefryna, który działa jak pseudoprzekaźnik i może pośredniczyć w niektórych efektach działania leku, zwłaszcza u osób przewlekle stosujących lek.
Interakcje z lekami
Acetazolamid: może zwiększać stężenie amfetaminy w osoczu.
Alkohol: może zwiększać stężenie amfetaminy w osoczu.
Kwas askorbowy: poprzez obniżenie pH moczu może zwiększać wydalanie amfetaminy.
Furazolidon: amfetaminy mogą wywoływać reakcję nadciśnieniową u pacjentów leczonych furazolidonem.
Guanetydyna: amfetaminy hamują przeciwnadciśnieniowe działanie guanetydyny.
Haloperidol: istnieją ograniczone dowody na to, że haloperidol może hamować działanie amfetaminy. Jednakże znaczenie kliniczne tej interakcji nie jest dobrze ustalone.
Węglan litu: istnieją pewne odosobnione dowody na to, że substancja ta może hamować działanie amfetaminy.
Oksydaza monoaminowa (MAO): amfetaminy powodują reakcję nadciśnieniową u pacjentów leczonych inhibitorami MAO.
Noradrenalina: nadużywanie amfetaminy może nasilać reakcję wazokonstrykcyjną noradrenaliny.
Fenotiazyny: amfetamina może hamować działanie przeciwpsychotyczne tych substancji, a fenotiazyny mogą hamować anorektyczne działanie amfetaminy.
Dwuwęglan sodu: duże dawki tej substancji hamują eliminację amfetaminy, zwiększając tym samym jej działanie.
Używanie tytoniu: amfetamina wydaje się wywoływać zależne od dawki zwiększenie używania tytoniu.
Trycykliczne leki przeciwdepresyjne: teoretycznie zwiększają działanie amfetaminy. Jednakże nie ma na to dowodów klinicznych.
Działania niepożądane u ludzi
Działania niepożądane są częściowo konsekwencją działania farmakologicznego. Mogą one wystąpić w każdej chwili, do tego stopnia, że dawki dobrze tolerowane jednego dnia mogą nie być tolerowane w innym dniu, prowadząc do działań niepożądanych. Należy pamiętać, że wielu użytkowników zażywa kilka tabletek tej samej nocy wraz z innymi substancjami. Czasami trudno jest ustalić przyczynę toksyczności. Zasadniczo, niepożądane efekty można zaobserwować na dwóch poziomach:
1. Mogą one powodować wysokie ciśnienie krwi, tachykardię, poważne zaburzenia rytmu serca, niedokrwienie mięśnia sercowego (dławicę piersiową) i ostry zawał serca. Wiąże się z nimi zwiększona częstość występowania nadciśnienia płucnego. Mogą wystąpić bóle głowy, drżenie, napięcie mięśni i żuchwy, zawroty głowy, ataksja, dystonia, drgawki i śpiączka. Zgłaszano ciężkie toksyczne zapalenie wątroby z martwicą wątroby, które może wymagać przeszczepienia wątroby. Efekty trawienne obejmują nudności i wymioty, krętactwo paralityczne i niedokrwienie jelit. Zagrażające życiu skutki obejmują krwotok podpajęczynówkowy, krwotok wewnątrzczaszkowy, zawał mózgu i zakrzepicę zatoki żylnej mózgu.
2. Psychologiczne. Może wystąpić dysforia, bezsenność, drażliwość, pobudzenie, wrogość i dezorientacja. W przypadku amfetaminy często pojawia się agresja, co prowadzi do przemocy i zachowań ryzykownych. Zaburzenia psychiczne obejmują lęk, napady lękowe, urojenia paranoidalne lub urojenia odniesienia i omamy.
Stosowanie terapeutyczne
Obecne wskazania terapeutyczne dla amfetamin są bardzo ograniczone.
Nie są one zalecane w celu zmniejszenia głodu w leczeniu otyłości. Jedyne dwa wskazania do ich stosowania to leczenie narkolepsji i zaburzeń koncentracji uwagi u dzieci. U tych dzieci najczęściej stosowaną substancją jest metylofenidat.
Podziękowania
Praca badawcza jest finansowana przez Ministerstwo Spraw Wewnętrznych poprzez Narodowy Plan Narkotykowy, przez Instytut Zdrowia Carlosa III (FIS 070709) oraz przez Sieć Zaburzeń Uzależniających RD 06/001/001.
Autor deklaruje, że nie ma konfliktu interesów.
Autor deklaruje, że nie ma konfliktu interesów.