JOP. Journal of the Pancreas
Ampullary Adenomas
Tumory brodawki Vatera są rzadkie, z częstością występowania 0,04%±0,12% podawaną w badaniach autopsyjnych. Mogą występować jako zmiany sporadyczne lub u pacjentów z rodzinną polipowatością gruczolakowatą. Histologicznie, udokumentowano złośliwą transformację łagodnych gruczolaków do raków. Odnotowana częstość występowania nowotworu złośliwego w gruczolaku brodawki waha się od 26 do 65%. Resztkowe ogniska gruczolaków, jak również obszary umiarkowanej lub ciężkiej dysplazji, zostały również znalezione nawet w 90% wycinków resekcyjnych raka brodawki większej. Na podstawie tych obserwacji uważa się, że gruczolaki brodawki większej lub mniejszej wykazują taką samą sekwencję gruczolak-rak jak gruczolaki jelita grubego
Z tych powodów całkowite usunięcie tych zmian jest obowiązkowe, ale leczenie z wyboru pozostaje kontrowersyjne.
Operacja stanowi tradycyjną opcję, w tym pankreatoduodenektomia, która charakteryzuje się śmiertelnością okołooperacyjną od 2 do 9% i bardzo znacznym odsetkiem powikłań pooperacyjnych (do 41% w dużej serii) oraz duodenotomia z miejscowym wycięciem; ta ostatnia jest z pewnością mniej inwazyjna, ale wiąże się z nawrotami miejscowymi.
Tak więc, ze względu na niską zachorowalność i śmiertelność, leczenie endoskopowe zyskuje coraz większy konsensus jako leczenie pierwszego wyboru, nawet jeśli trudna lokalizacja anatomiczna tych zmian sprawia, że resekcja jest znacznie bardziej złożoną procedurą w porównaniu z polipektomią w okrężnicy; ponadto, kolejna operacja u operowalnych pacjentów nie jest wykluczona przez wcześniejszą resekcję endoskopową .
Preoperative Evaluation: How to Choose the Treatment?
Na podstawie samego wyglądu endoskopowego gruczolaki ampułkowe nie zawsze można odróżnić od raków ampułkowych lub polipów bez gruczolaków (carcinoid tumors, gangliocytic paragangliomas itp.).
W związku z tym ostateczne rozpoznanie tkankowe jest warunkiem wstępnym właściwego postępowania, ale biopsja kleszczowa w pewnym odsetku przypadków nie pozwala na prawidłowe określenie histologiczne zmiany.
W celu przezwyciężenia tej trudności niektórzy autorzy proponują szersze zastosowanie diagnostyczne i terapeutyczne ampulektomii zamiast biopsji kleszczowej: jakość materiału histologicznego może być lepsza, diagnoza patologiczna dokładniejsza, a zapotrzebowanie na nowe biopsje znacznie zmniejszone.
Innym ważnym punktem ciężkości w ocenie zaawansowania choroby jest ocena wewnątrzprzewodowego rozrostu dróg żółciowych i/lub trzustki, który przez wielu autorów jest uważany za przeciwwskazanie do leczenia endoskopowego; dlatego endoskopowa cholangiopankreatografia wsteczna (ECPW) z bocznym duodenoskopem jest wymagana u wszystkich pacjentów w celu uzyskania zarówno cholangiogramu, jak i pankreatogramu przed resekcją, aby wykazać potencjalne wewnątrzprzewodowe rozszerzenie guza.
Oprócz ECPW można wykonać endoskopową ultrasonografię (EUS) i/lub ultrasonografię wewnątrzprzewodową (IDUS) w celu uzyskania bardziej szczegółowych i dokładnych informacji na temat rozległości zmiany brodawkowatej, takich jak wielkość i echogeniczność guza, struktury warstwowe ściany dwunastnicy i stan regionalnych węzłów chłonnych. Dane z piśmiennictwa wskazują na wyższość liniowej EUS nad spiralną TK w przedoperacyjnej ocenie wielkości guza, wykrywaniu regionalnych przerzutów węzłowych oraz wykrywaniu inwazji głównych naczyń krwionośnych u pacjentów z nowotworami złośliwymi okołobrodawkowymi. Badanie EUS metodą liniową poprawiło przedoperacyjną ocenę zaawansowania miejscowego nowotworów złośliwych okołobłoniastych, gdy przypadki porównano na podstawie wyników uzyskanych podczas operacji (tabele 1 i 2).
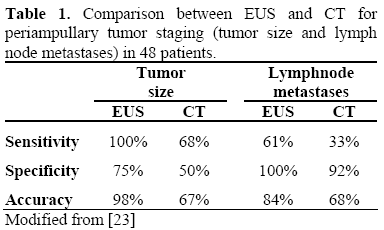
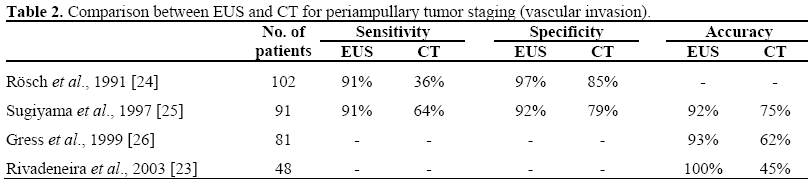
Nie ma zgody co do tego, które gruczolaki ampułki powinny pozostawać pod obserwacją, a które zmiany powinny być usuwane endoskopowo lub chirurgicznie.
Kilku autorów opowiedziało się za tym, że endoskopowa resekcja powinna być wykonywana tylko u pacjentów bez dowodów na inwazyjność raka. Dla innych autorów resekcja endoskopowa nie jest kontrowersyjna nawet w przypadku dowodów dysplazji wysokiego stopnia.
Tabela 3 przedstawia kryteria endoskopowej resekcyjności najczęściej opisywane w literaturze. Należy zauważyć, że istnieje znaczna zmienność w kryteriach włączenia. Niektórzy autorzy wykluczają zmiany większe niż 4-4,5 cm do resekcji miejscowej, podczas gdy inni je uwzględniają; zastosowanie resekcji fragmentarycznej, gdy jest to właściwe, przyczyniło się do zwiększenia rozmiarów leczonych zmian: na przykład, guzy o średnicy do 7 cm były skutecznie resekowane.

Jednakże kluczową kwestią jest histologiczna ocena gruczolaków ampułkowych. Generalnie, wycięcie miejscowe jest akceptowanym leczeniem leczniczym w przypadku gruczolaka z wewnątrznabłonkową neoplazją/nowotworem in situ o wysokim stopniu złośliwości (HGIN/Tis). W raku T1, definiowanym według klasyfikacji TNM jako guz ograniczony do ampułki lub zwieracza Oddiego, inwazja naczyń limfatycznych lub przerzuty do węzłów chłonnych oraz zajęcie przewodów występują odpowiednio w 10-50% i 20-40% przypadków. Dlatego w tym przypadku istnieje większe prawdopodobieństwo niekompletnej resekcji i/lub nawrotu raka; podobnie jak w przypadku gruczolaków jelita grubego, endoskopowa ampulektomia może być sposobem na wyleczenie raka T1 bez inwazji naczyń limfatycznych, jeśli badanie histologiczne całego wyciętego fragmentu potwierdzi całkowite usunięcie raka .
Ponadto, kolejnym istotnym zagadnieniem jest rozrost wewnątrzprzewodowy, który może występować zarówno w gruczolakach Tis, jak i T1, a także w gruczolakach z dysplazją małego stopnia. Bohnacker i wsp. sugerują, że operacja jest zalecana w przypadku rozrostu wewnątrzprzewodowego w Tis i T1; w gruczolakach z dysplazją niskiego stopnia, jeśli rozrost wewnątrzprzewodowy jest mniejszy niż 1 cm, nadal istnieje możliwość wyboru resekcji endoskopowej. W każdym razie, chirurgia pozostaje jedynym wyborem w przypadku niekompletnego usunięcia i jeśli złośliwość jest wyraźnie obecna .
Rysunek 1 pokazuje możliwy schemat przepływu dla ukierunkowania kroków terapeutycznych.
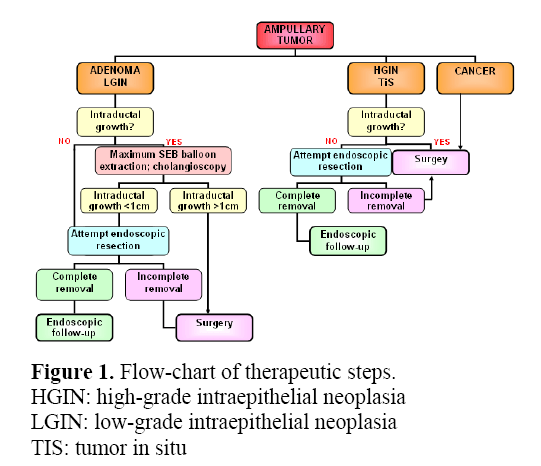
Rysunek 1. Schemat blokowy etapów terapeutycznych.
HGIN: high-grade intraepithelial neoplasia
LGIN: low-grade intraepithelial neoplasia
TIS: tumor in situ
W obecności rodzinnej polipowatości gruczolakowatej należy przedstawić pewne zalecenia. U tych chorych bardzo często rozwijają się gruczolaki w drugiej części dwunastnicy, w tym w brodawce Vatera, ale pankreatoduodenektomia nie zawsze jest obowiązkowa.
Ryzyko wystąpienia raka ocenia się według klasyfikacji Spigelmana (tab. 4) . U około 10-30% pacjentów z rodzinną polipowatością gruczolakowatą rozwija się gruczolakowatość dwunastnicy w stopniu IV według klasyfikacji Spigelmana; mutacje w dół od kodonu 1051 wydają się być związane z poważnymi zmianami okołotrzustkowymi. U tych pacjentów skumulowane ryzyko zachorowania na raka wynosi 30-40% i dlatego należy rozważyć profilaktyczną pankreatoduodenektomię.
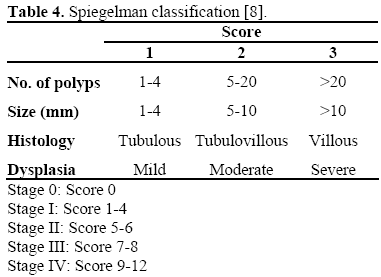
W pozostałych stadiach można zastosować leczenie endoskopowe (ewentualnie połączone z chemioprewencją w stadiach II-III) z dokładną obserwacją endoskopową po całkowitym wycięciu zmiany okołotrzustkowej.
Techniques of Endoscopic Snare Papillectomy
Techniques for the endoscopic removal of ampullary adenomas remain nonstandardized, probably due to the relatively small number of procedures of this type Należy pamiętać, że termin ”ampullectomy” odnosi się do usunięcia całej ampulli Vatera i jest terminem chirurgicznym dla procedur, które wymagają chirurgicznej reimplantacji dystalnego przewodu żółciowego wspólnego i przewodu trzustkowego w obrębie ściany dwunastnicy.
Technicznie, kiedy wykonywane są endoskopowe resekcje zmian w brodawce większej, tylko tkanka z brodawki może być usunięta endoskopowo i dlatego termin ”papillektomia” jest bardziej odpowiedni niż termin ”ampulektomia”, chociaż te dwa terminy są często używane zamiennie w literaturze.
Brodawki dwunastnicy (większe i mniejsze) powinny być kontrolowane przy użyciu endoskopu z bocznym podglądem (duodenoskopu), ponieważ patologia brodawek jest łatwo przeoczona przy użyciu instrumentów z podglądem do przodu. Niektórzy autorzy zalecają wykonanie przed resekcją iniekcji podśluzówkowej, ale nie jest ona rutynowo wymagana (podobnie jak przed endoskopową resekcją błony śluzowej w przypadku polipów jelita grubego). Brak objawu „uniesienia” zmiany wiąże się ze złośliwością i jest uważany przez wielu autorów za przeciwwskazanie do próby całkowitej resekcji endoskopowej.
Przeciwnie, niektórzy badacze nie zalecają wykonywania iniekcji podśluzówkowej, ponieważ uchwycenie zmiany za pomocą pętli może być trudne, a także dlatego, że iniekcja podśluzówkowa może zatrzeć margines guza i nie podnosi przewodu żółciowego, który przebiega przez ścianę dwunastnicy.
Endoskopowa papillektomia jest wykonywana za pomocą endoskopowych pętli i elektrokauteryzacji. W większości doniesień stosowano standardowe „plecione” pętle do polipektomii, chociaż dostępne są pętle z cienkiego drutu zaprojektowane specjalnie do resekcji ampułki. Nie ma dowodów dokumentujących przewagę jednego typu pętli nad innymi.
Jeśli zmiana może być całkowicie uchwycona, można wykonać resekcję en bloc. Zaletą resekcji en bloc jest potencjalne skrócenie czasu zabiegu, mniejsze zapotrzebowanie na elektrokauteryzację oraz dostarczenie kompletnej próbki tkanki do oceny patologicznej. Jednakże, resekcja fragmentaryczna jest często wykonywana w przypadku zmian większych niż 2 cm, w przypadkach, gdy próba resekcji en bloc pozostawiła widoczną tkankę nowotworową na miejscu lub w celu zminimalizowania ryzyka perforacji. Resekcja fragmentaryczna może spowodować uszkodzenie fragmentów tkanki wysyłanych do analizy patologicznej w wyniku działania elektrokauteryzmu. Większe zmiany mogą wymagać wielu zabiegów endoskopowych w celu ich całkowitego usunięcia. Większość opublikowanych serii donosi o zastosowaniu kombinacji technik resekcji en bloc i fragmentarycznej, ponieważ typy leczonych zmian były zróżnicowane pod względem wielkości i struktury. Nie ma zgodności co do tego, jaki rodzaj prądu powinien być stosowany podczas endoskopowej papillectomii. Stosowano zarówno czysty prąd tnący, jak i prąd mieszany lub endocut, przy czym obecnie nie udowodniono przewagi żadnego z nich nad drugim. Ustawienia mocy nie są również znormalizowane .
Po papillektomii (en bloc lub fragmentarycznie) laser Nd:YAG lub argonowej koagulacji plazmowej może być stosowany do usuwania pozostałej tkanki gruczolakowatej . Pancreatic lub żółciowe sfinkterotomii może pomóc w dostarczaniu trzustkowo-żółciowego drenażu po papillectomy i może uprościć próby dostępu do przewodu żółciowego wspólnego i przewodu trzustkowego dla stentu umieszczenie. Mogą one również pomóc w nadzorze endoskopowym po zabiegu.
Kilka badań wykazało, że umieszczenie profilaktycznego stentu przewodu trzustkowego zmniejsza ryzyko zapalenia trzustki po ECPW, minimalizując ryzyko zwężenia otworu przewodu trzustkowego, a także może pozwolić na bezpieczniejsze stosowanie dodatkowych terapii koagulacyjnych, ale teoria ta jest niepotwierdzona. Inni zalecają umieszczenie stentu trzustkowego tylko wtedy, gdy przewód trzustkowy nie drenuje się po papillektomii .
W badaniu Zádorová i wsp. wskaźnik zapalenia trzustki u pacjentów, którzy przeszli papillektomię z i bez stentu trzustkowego wynosił 0% i 20%, odpowiednio. W wieloośrodkowym badaniu stwierdzono, że pooperacyjne zapalenie trzustki występowało częściej u pacjentów, u których nie założono stentu trzustkowego (17% vs. 3,3%), choć różnica ta nie była istotna statystycznie. W badaniu Cheng i wsp. profilaktyczne założenie stentu trzustkowego wiązało się z mniejszym odsetkiem zapalenia trzustki poESP (9,6% vs. 25%; P=0,33).
Jedyna prospektywna, randomizowana, kontrolowana próba oceniająca rolę profilaktycznego stentowania przewodu trzustkowego w celu zmniejszenia zapalenia trzustki po endoskopowej papillektomii wykazała jednak statystycznie istotne zmniejszenie częstości występowania pooperacyjnego zapalenia trzustki w grupie stosującej stent. Na podstawie tych danych zaleca się profilaktyczne stentowanie przewodu trzustkowego podczas zabiegu papillektomii w celu zmniejszenia ryzyka wystąpienia pooperacyjnego zapalenia trzustki, natomiast nie ma danych, jak długo przewód powinien być stentowany .
Pomimo, że istnieje szeroka dyskusja na temat zakładania stentów do przewodu trzustkowego, istnieje również pytanie dotyczące potrzeby drenażu dróg żółciowych po papillektomii. Istnieją sporadyczne doniesienia o zakładaniu stentów do dróg żółciowych po endoskopowej papillektomii, przy czym średnica używanego stentu waha się od 7F do 10F. Drenaż dróg żółciowych może być ważną alternatywą dla stentu, umożliwiając kontrolę rentgenowską drenażu dróg żółciowych przez kilka dni po zabiegu bez konieczności ponownego badania endoskopowego.
Teoretycznie zapalenie dróg żółciowych może wystąpić po endoskopowej papillektomii w wyniku tego samego mechanizmu patogenetycznego, co zapalenie trzustki po papillektomii i w efekcie opisano przypadek zapalenia dróg żółciowych po endoskopowej papillektomii. W każdym razie profilaktyczne stentowanie dróg żółciowych w celu zmniejszenia ryzyka pooperacyjnego zapalenia dróg żółciowych nie było powszechnie wykonywane i nie może być obecnie jednolicie zalecane, chyba że istnieje obawa o nieodpowiedni drenaż dróg żółciowych po papillektomii.
Powikłania
Endoskopowe usunięcie gruczolaków ampułkowych jest uważane za procedurę ”wysokiego ryzyka” powikłań, z zachorowalnością i śmiertelnością wynoszącą odpowiednio 23% (zakres 10-58%) i 0,4% (zakres 0- 7%). Powikłania zgłaszane przez duże, trzeciorzędowe ośrodki referencyjne i doświadczonych endoskopistów terapeutycznych są następujące: zapalenie trzustki od 8 do 15%, perforacja od 0 do 4%, krwawienie od 2 do 13%, zapalenie dróg żółciowych od 0 do 2% i zwężenie brodawki od 0 do 8%. Dlatego należy rozważyć okres obserwacji szpitalnej po zabiegu w celu wykrycia i leczenia wszelkich natychmiastowych lub nieco opóźnionych powikłań, zwłaszcza po rozległym usunięciu i leczeniu dużych zmian, u pacjentów z chorobami współistniejącymi, u tych, którzy nie mają łatwego dostępu do opieki medycznej i u tych, którzy nie mają środków wsparcia.
Większość przypadków krwawienia opisywanych w piśmiennictwie dotyczy krwawienia proceduralnego i została opanowana endoskopowo podczas tego samego zabiegu. Konsensus opinii jest taki, że nie powinny być one traktowane jako powikłania. Opóźnione krwawienie odnotowano w około 3% przypadków i zazwyczaj było ono również leczone zachowawczo lub poprzez ponowną interwencję endoskopową. Odnotowano tylko kilka przypadków ciężkiego zapalenia trzustki wymagającego dłuższej hospitalizacji. Chirurgia jest rzadko wymagana .
Późne powikłania obejmują rozwój zwężenia przewodu trzustkowego lub dróg żółciowych; powikłania te wydają się częstsze u pacjentów bez stentów przewodu trzustkowego umieszczonych po papillectomii (15.4%) w stosunku do chorych, którym założono stenty trzustkowe (1,1%) . Niektórzy autorzy sugerują, że możliwe jest zmniejszenie odsetka powikłań poprzez rutynową sfinkterotomię żółciową i trzustkową, założenie stentu trzustkowego przed resekcją, podśluzówkowe wstrzyknięcie epinefryny i resekcję fragmentaryczną w większych zmianach.
Wyniki leczenia endoskopowego
Wyniki leczenia endoskopowego guzów ampulla opisywanych w piśmiennictwie przedstawiono w tabeli 5. Należy zwrócić uwagę, że w badaniu Catalano i wsp, odsetek powodzeń był związany ze starszym wiekiem (54,7 vs. 46,6 lat; P=0,08), mniejszymi zmianami (21,1 vs. 29,7 mm; P<0,0001) i zmianami sporadycznymi (63 z 72 vs. 20 z 31; P=0,02) .
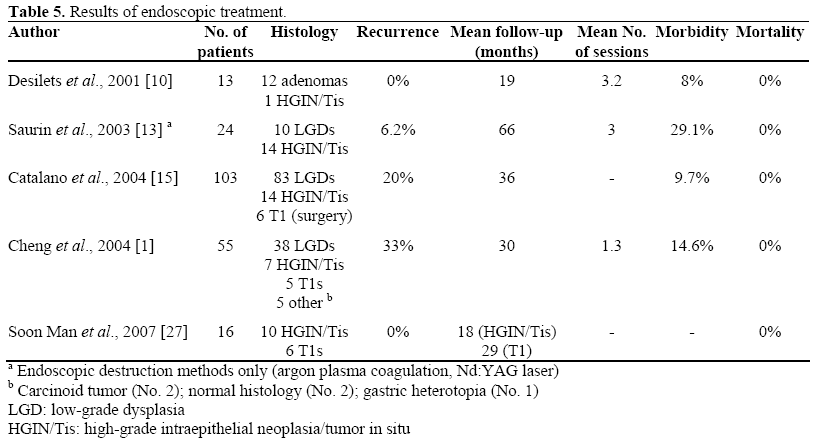
Bohnacker i wsp. skupili wyniki na obecności lub braku wewnątrzprzewodowego wzrostu guza; w swoim raporcie przeprowadzonym na 106 pacjentach badanych przez medianę obserwacji 43 miesięcy, autorzy stwierdzili, że endoskopowa resekcja była lecznicza u 83% pacjentów bez wewnątrzprzewodowego wzrostu i u 46% pacjentów z wewnątrzprzewodowym wzrostem (P<0.001), konkludując, że endoskopowa ampulektomia jest bezpieczna i skuteczna, i może być wykonalna w przypadkach wewnątrzprzewodowych rozrostów mniejszych niż 1 cm.
W badaniu Cheng i wsp, sześciu pacjentów (spośród 55 włączonych do badania) miało rozrosty wewnątrzprzewodowe: dwóch poddano resekcji chirurgicznej, uważanej za leczenie z wyboru; czterech pacjentów (złych kandydatów do operacji lub odmawiających operacji) poddano terapii wewnątrzprzewodowej za pomocą lasera Nd:YAG (2 pacjentów) lub endoskopowej resekcji ślimakowej (2 pacjentów). U tych czterech pacjentów guz wewnątrzprzewodowy został usunięty, chociaż u jednego z pacjentów, u którego zastosowano laseroterapię, wystąpił nawrót choroby w średnim okresie obserwacji wynoszącym 12 miesięcy. Autorzy sugerują zatem, że u pacjentów niekwalifikujących się do zabiegu operacyjnego gruczolak wewnątrzprzewodowy może być usunięty również bez uwzględnienia granicy wskazanej przez Bohnackera (guz wystający mniej niż 1 cm od otworu żółciowego).
Odsetek nawrotów podawany w literaturze waha się od 0 do 33%; czynniki predysponujące wydają się dotyczyć większych rozmiarów i predyspozycji genetycznych; zastosowanie adjuwantowej ablacji termicznej może zmniejszyć odsetek nawrotów, nawet jeśli technika ta wiąże się również z rosnącą zachorowalnością. Jednakże bardzo często tkanka nawrotowa ma ograniczone rozmiary, jest histologicznie łagodna, bez rozrostu wewnątrzprzewodowego i dlatego łatwo poddaje się technikom endoskopowym
Surveillance after Endoscopic Treatment
An optimal program of surveillance after complete excision of ampullary tumor is not standardized. Na podstawie doświadczeń opisanych w literaturze wydaje się, że po całkowitym wycięciu guza wskazane jest wykonywanie ECPW z biopsją okolicy nadbrodawkowej co 6 miesięcy przez 2 lata.
W przypadku braku nawrotu po 2 latach, nadzór endoskopowy powinien być prowadzony częściej u pacjentów z rodzinną polipowatością gruczolakowatą niż u pacjentów ze zmianami sporadycznymi, ze względu na dużą częstość występowania gruczolaków dwunastnicy i ryzyko raka okołobrodawkowego. Dlatego pacjenci z rodzinną polipowatością gruczolakowatą powinni być poddawani endoskopii w odstępach 3-letnich, natomiast pozostali pacjenci powinni powtarzać endoskopię tylko w przypadku wystąpienia objawów .
Wnioski
Endoskopowe leczenie gruczolaków brodawki większej dwunastnicy jest bezpieczną, dobrze tolerowaną alternatywą dla leczenia chirurgicznego. W rękach ekspertów powikłania są rzadkie, a zabieg operacyjny na ogół nie jest wymagany. Kwalifikujący się pacjenci muszą być starannie wyselekcjonowani, a endoskopowa obserwacja musi być zapewniona. Dłuższa obserwacja jest potrzebna, aby określić rzeczywisty odsetek nawrotów (33% w literaturze) i długoterminowe wyniki leczenia endoskopowego.
Konflikt interesów
Autorzy nie mają potencjalnych konfliktów interesów
- Cheng CL, Sherman S, Fogel EL, McHenry L, Watkins JL, Fukushima T, et al. Endoscopic snare papillectomy for tumors of the duodenal papillae. Gastrointest Endosc 2004; 60:757-64.
- Yeo CJ, Cameron JL, Sohn TA, Lillemoe KD, Pitt HA, Talamini MA, et al. Six hundred fifty consecutive pancreaticoduodenectomies in the 1990s: pathology, complications, and outcomes. Ann Surg 1997; 226:248-60.
- Bohnacker S, Soehendra N, Maguchi H, Chung JB, Howell DA. Endoscopic resection of benign tumors of the papilla of vater. Endoscopy 2006; 38:521-5.
- Standards of Practice Committee, Adler DG, Qureshi W, Davila R, Gan SI, Lichtenstein D, et al. The role of endoscopy in ampullary and duodenal adenomas. Gastrointest Endosc 2006; 64:849-54.
- Elek G, Gyôri S, Tóth B, Pap A. Histological evaluation of preoperative biopsies from ampulla vateri. Pathol Oncol Res 2003; 9:32-41.
- Seewald S, Omar S, Soehendra N. Endoscopic resection of tumors of the ampulla of Vater: how far up and how deep down can we go? Gastrointest Endosc 2006; 63:783-8.
- Bohnacker S, Seitz U, Nguyen D, Thonke F, Seewald S, deWeerth A, et al. Endoscopic resection of benign tumors of the duodenal papilla without and with intraductal growth. Gastrointest Endosc 2005; 62:551- 60.
- Groves CJ, Saunders BP, Spigelman AD, Phillips RK. Duodenal cancer in patients with familial adenomatous polyposis (FAP): results of a 10 year prospective study. Gut 2002; 50:636-41.
- Björk J, Akerbrant H, Iselius L, Bergman A, Engwall Y, Wahlström J, et al. Periampullary adenomas and adenocarcinomas in familial adenomatous polyposis: cumulative risks and APC gene mutations. Gastroenterology 2001; 121:1246-8.
- Desilets DJ, Dy RM, Ku PM, Hanson BL, Elton E, Mattia A, Howell DA. Endoscopic management of tumors of the major duodenal papilla: refined techniques to improve outcome and avoid complications. Gastrointest Endosc 2001; 54:202-8.
- Eswaran SL, Sanders M, Bernadino KP, Ansari A, Lawrence C, Stefan A, et al. Success and complications of endoscopic removal of giant duodenal and ampullary polyps: a comparative series. Gastrointest Endosc 2006; 64:925-32.
- Norton ID, Gostout CJ, Baron TH, Geller A, Petersen BT, Wiersema MJ. Safety and outcome of endoscopic snare excision of the major duodenal papilla. Gastrointest Endosc 2002; 56:239-43.
- Saurin JC, Chavaillon A, Napoléon B, Descos F, Bory R, Berger F, Ponchon T. Long-term follow-up of patients with endoscopic treatment of sporadic adenomas of the papilla of vater. Endoscopy 2003; 35:402-6.
- Martin JA, Haber GB, Kortan PP, Raijman I, Abedi M, DuVall GA. Endoscopic snare ampullectomy for resection of benign ampullary neoplasms. Gastrointest Endosc 1997; 45:AB139.
- Catalano MF, Linder JD, Chak A, Sivak MV Jr, Raijman I, Geenen JE, Howell DA. Endoscopic management of adenoma of the major duodenal papilla. Gastrointest Endosc 2004; 59:225-32.
- Binmoeller KF, Boaventura S, Ramsperger K, Soehendra N. Endoscopic snare excision of benign adenomas of the papilla of Vater. Gastrointest Endosc 1993; 39:127-31.
- Zádorová Z, Dvofák M, Hajer J. Endoscopic therapy of benign tumors of the papilla of Vater. Endoscopy 2001; 33:345-7.
- Tarnasky PR, Palesch YY, Cunningham JT, Mauldin PD, Cotton PB, Hawes RH. Pancreatic stenting prevents pancreatitis after biliary sphincterotomy in patients with sphincter of Oddi dysfunction. Gastroenterology 1998; 115:1518-24.
- Fazel A, Quadri A, Catalano MF, Meyerson SM, Geenen JE. Does a pancreatic duct stent prevent post- ERCP pancreatitis? Prospektywne badanie z randomizacją. Gastrointest Endosc 2003; 57:291-4.
- Harewood GC, Pochron NL, Gostout CJ. Prospective, randomized, controlled trial of prophylactic pancreatic stent placement for endoscopic snare excision of the duodenal ampulla. Gastrointest Endosc 2005; 62:367-70.
- Choi JJ, Kim MH, Kim GD, Kim JK, Park JT, Oh DR, Seo WJ, et al. Papillary stenosis and cholangitis caused by endoscopic mucosal resection of ampullary adenoma. Korean J Gastrointest Endosc 2003; 27:249- 53.
- Katsinelos P, Paroutoglou G, Kountouras J, Beltsis A, Papaziogas B, Mimidis K, et al. Safety and longterm follow-up of endoscopic snare excision of ampullary adenomas. Surg Endosc 2006; 20:608-13.
- Rivadeneira DE, Pochapin M, Grobmyer SR, Lieberman MD, Christos PJ, Jacobson I, Daly JM. Comparison of linear array endoscopic ultrasound and helical computed tomography for the staging of periampullary malignancies. Ann Surg Oncol 2003; 10:890-7.
- Rösch T, Lorenz R, Braig C, Feuerbach S, Siewert JR, Schusdziarra V, Classen M. Endoscopic ultrasound in pancreatic tumor diagnosis. Gastrointest Endosc 1991; 37:347-52.
- Sugiyama M, Hagi H, Atomi Y, Saito M. Diagnosis of portal venous invasion by pancreatobiliary carcinoma: value of endoscopic ultrasonography. Abdom Imaging 1997; 22:434-8.
- Gress FG, Hawes RH, Savides TJ, Ikenberry SO, Cummings O, Kopecky K, et al. Role of EUS in the preoperative staging of pancreatic cancer: a large single-center experience. Gastrointest Endosc 1999; 50:786-91.
- Yoon SM, Kim MH, Kim MJ, Jang SJ, Lee TY, Kwon S, et al. Gastrointest Endosc 2007; 66:701-7.