Uczeń chemii
Trójfluorek bromu jest toksycznym związkiem interhalogenowym. Jest znany z zastosowań jako silny środek fluoryzujący.
- Trójfluorek bromu Identyfikacja
- Wzór chemiczny dla trifluorku bromu
- Produkcja trójfluorku bromu
- Trójfluorek bromu Skład
- Właściwości trifluorku bromu
- Wygląd
- Odór
- Higroskopia
- Masa molowa
- Masa monoizotopowa
- Gęstość
- Kolejność topnienia
- Kolejna temperatura wrzenia
- Przewodnictwo
- Korozja
- Gęstość właściwa
- Moment dipolowy
- Rozpuszczalność
- Struktura trifluorku bromu
- Trójfluorek bromu Reakcje
- Trójfluorek bromu Zastosowania
- Trójfluorek bromu MSDS
- Zagrożenia dla zdrowia
- Środki pierwszej pomocy
- Profil reaktywności
- Środki przeciwpożarowe
- Środki zapobiegające przypadkowemu uwolnieniu do środowiska
- Postępowanie z trifluorkiem bromu
- Magazynowanie trifluorku bromu
- Ochrona osobista
Trójfluorek bromu Identyfikacja
Numer CAS: 7787-71-5
Numer ONZ: UN1746
PubChem Compound ID: 24594
ChemSpider Reference Number: 20474213
Numer MDL: MFCD00042533
NumerEC: 232-132-1
Numer RTTECS: ED2275000
InChI Identifier: InChI=1S/BrF3/c2-1(3)4
Klucz InChI: InChIKey=FQFKTKUFHWNTBN-UHFFFAOYSA-N
Wzór chemiczny dla trifluorku bromu
Wzór chemiczny dla tego związku interhalogenowego to BrF3.
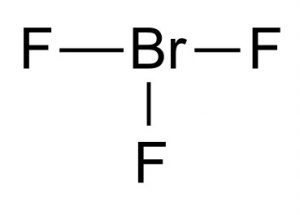
Zdjęcie 1 – Trójfluorek bromu
Produkcja trójfluorku bromu
W roku 1906 Paul Lebeau zsyntetyzował ten związek po raz pierwszy poprzez reakcję bromu z fluorem w temperaturze 20°C. Reakcja ta jest reprezentowana przez następujące równanie:
Br2 + 3F2 → 2BrF3
Innym sposobem wytwarzania trifluorku bromu jest jednoczesna redukcja i utlenianie monofluorku bromu. W tej reakcji powstaje trójfluorek bromu i brom.
3BrF → BrF3 + Br2
Trójfluorek bromu Skład
Trójfluorek bromu składa się z 58,367% bromu i 41.632% fluoru.
Właściwości trifluorku bromu
Właściwości fizyczne i chemiczne tej substancji omówiono poniżej:
Wygląd
Jest to ciecz o słomkowej barwie.
Odór
Czynnik ten ma ostry zapach.
Higroskopia
Jest to ciecz higroskopijna.
Masa molowa
Masa molowa trifluorku bromu wynosi 136.90 g/mol.
Masa monoizotopowa
Masa monoizotopowa tej substancji wynosi 135.913547 u (zunifikowane atomowe jednostki masy).
Gęstość
Gęstość tej substancji wynosi 2,803 g/cm3.
Kolejność topnienia
Kolejność topnienia trójfluorku bromu wynosi 8,77°C.
Kolejna temperatura wrzenia
Kolejna temperatura wrzenia tej substancji wynosi 125,72°C.
Przewodnictwo
Dzięki autojonizacji ciecz jest dobrym przewodnikiem elektryczności.
Korozja
Jest cieczą korozyjną.
Gęstość właściwa
Gęstość właściwa trifluorku bromu wynosi 2,81 w temperaturze 68,0°F.
Moment dipolowy
Molekularny moment dipolowy tej substancji wynosi 1,19 Debye’a.
Rozpuszczalność
Trójfluorek bromu jest rozpuszczalny w kwasie siarkowym. Rozkłada się i wybucha w kontakcie ze związkami organicznymi i wodą. Reakcje ze związkami zawierającymi wodór mogą powodować gwałtowne reakcje. Wiele fluorków jonowych łatwo rozpuszcza się w trifluorku bromu i tworzy solwobazę.
KF + BrF3 → KBrF4
Oprócz wyżej wymienionych właściwości, trifluorek bromu jest również silnym środkiem fluoryzującym.
Struktura trifluorku bromu
Struktura Lewisa trifluorku bromu pokazuje, że ma on strukturę molekularną w kształcie litery T. Zgodnie z teorią VSEPR tworzenia cząsteczek, centralny brom jest połączony z dwiema parami elektronowymi. Odległość pomiędzy centrum bromu a fluorem równikowym wynosi 1,72 Å, a do każdego z fluorków osiowych 1,81 Å. Kąt pomiędzy fluorem równikowym a fluorem osiowym wynosi 86,2°. Kąt jest utrzymywany nieco mniej niż 90°, ponieważ siła odpychania od wiązań Br-F jest mniejsza niż siła par elektronów.
Trójfluorek bromu Reakcje
Trójfluorek bromu w reakcji z tlenkami metali wydziela tlen. W reakcji trójfluorku bromu z ditlenkiem krzemu powstaje gazowy tetrafluorek krzemu i brom.
W reakcji trójfluorku bromu z tlenkiem tytanu(IV) powstaje fluorek tytanu(IV) i brom.
Trójfluorek bromu Zastosowania
Trójfluorek bromu jest silnie jonizującym rozpuszczalnikiem nieorganicznym i środkiem fluoryzującym. Jest również stosowany do produkcji sześciofluorku uranu (UF6) podczas przetwarzania i przerobu paliwa jądrowego.
Trójfluorek bromu MSDS
Zagrożenia dla zdrowia
Człowiek narażony na działanie trójfluorku bromu może cierpieć na następujące problemy zdrowotne:
Kontakt ze skórą: Kontakt skóry z tym związkiem chemicznym może prowadzić do uczucia pieczenia i podrażnienia.
Kontakt z oczami: Jeśli oczy wejdą w kontakt z oparami chemicznymi lub samą substancją chemiczną, może to prowadzić do poważnego pieczenia oczu, owrzodzeń, a nawet ślepoty.
Zjedzenie: Połknięcie prowadzi do ciężkiego pieczenia błon śluzowych.
Wdychanie: Wdychanie może prowadzić do silnego podrażnienia górnych dróg oddechowych.
Środki pierwszej pomocy
Oczy: Oczy należy dokładnie przemywać dużą ilością wody przez co najmniej 15 minut. Należy natychmiast skonsultować się z lekarzem.
Skóra: Jeśli skóra wejdzie w kontakt z substancją chemiczną, zainfekowane miejsca należy dobrze umyć wodą z mydłem przez minimum 15 minut. Wymagana jest natychmiastowa pomoc medyczna. Skażona odzież musi być szybko usunięta. Odzież powinna być dokładnie wyczyszczona i wysuszona przed ponownym użyciem. Zanieczyszczone obuwie należy zniszczyć.
Ingestion: W razie przypadkowego połknięcia, poszkodowany powinien wypić dużą ilość wody. Nie zaleca się wywoływania wymiotów.
Wdychanie: W przypadku wystąpienia działań niepożądanych, poszkodowany powinien zostać przeniesiony do nieskażonego obszaru. Należy zastosować sztuczne oddychanie w przypadku, gdy poszkodowany nie oddycha. Jeśli oddychanie i oddychanie jest nadal utrudnione, należy podać tlen. Dalsza pomoc medyczna jest wymagana w celu zapewnienia bezpieczeństwa ofiary.
Profil reaktywności
Trójfluorek bromu jest wysoce reaktywnym środkiem utleniającym. Reaguje gwałtownie, gdy wchodzi w kontakt z wodą. Może przyspieszać spalanie substancji łatwopalnych. Gdy wejdzie w kontakt z substancjami zawierającymi wodór, takimi jak kwas octowy, amoniak i metan, może spowodować wybuch i pożar. Gwałtownie reaguje również z kwasami, halogenami, halogenkami metali, metalami i tlenkami metali w temperaturze pokojowej. W szczególności powoduje niebezpieczne reakcje z kwasem azotowym, kwasem siarkowym, jodem i selenem.
Środki przeciwpożarowe
Trójfluorek bromu jest utleniaczem i dlatego może się zapalić lub wybuchnąć, gdy wejdzie w kontakt z materiałami palnymi.
W przypadku dużych pożarów, obszar powinien zostać odizolowany i zalany wodą z bezpiecznej odległości. Jeżeli pojemniki przechowujące trifluorek bromu znajdują się w pobliżu ognia, należy je usunąć, jeżeli można to zrobić bezpiecznie. Pojemniki powinny być chłodzone wodą płynącą nawet długo po ugaszeniu pożaru.
Środki gaśnicze: Podczas gaszenia pożaru należy stosować odpowiednie środki gaśnicze. Do gaszenia pożaru zaleca się stosowanie wody, suchej chemii lub sody kalcynowanej.
Środki zapobiegające przypadkowemu uwolnieniu do środowiska
Materiały palne powinny być odizolowane i należy unikać jakiegokolwiek połączenia z nimi. Rozlany materiał nie powinien być dotykany. Wyciek chemiczny powinien zostać zatrzymany, jeżeli jest to możliwe bez ryzyka dla osób. Rozprzestrzenianie się oparów chemicznych powinno być zmniejszone przez rozpylanie wody. Należy uważać, aby woda nie dostała się do wnętrza pojemników z chemikaliami. W przypadku dużych rozlewów, chemikalia powinny być poddane kwarantannie w celu ich późniejszej utylizacji. Obszar ten powinien być odpowiednio wentylowany.
Postępowanie z trifluorkiem bromu
Postępowanie z tym materiałem podlega przepisom dotyczącym postępowania zgodnie z U.S. OSHA 29 CFR 1910.119.
Magazynowanie trifluorku bromu
Czynnik chemiczny powinien być przechowywany i obsługiwany zgodnie z aktualnymi standardami i przepisami NFPA 430 Code for the storage of Liquid and Solid Oxidizing Materials. Pojemniki z chemikaliami powinny być chronione przed wszelkiego rodzaju uszkodzeniami fizycznymi. Powinny być również trzymane z dala od wszelkich niezgodnych substancji.
Ochrona osobista
Podczas pracy z tą substancją chemiczną należy zastosować odpowiednią ochronę. Należy stosować odpowiedni sprzęt ochronny. Idealnie powinny one obejmować:
- MSHA/NIOSH (zatwierdzony lub równoważny) niezależny aparat oddechowy z maskami tlenowymi na żądanie ciśnienia jest wymagany do prawidłowego oddychania.
- Zatwierdzone przez OSHA okulary ochronne lub gogle ochronne są wymagane do ochrony oczu.
- Aby chronić skórę przed szkodliwymi infekcjami wynikającymi z kontaktu z chemikaliami, należy stosować odzież i rękawice ochronne.
Oprócz wyżej wymienionego sprzętu ochronnego, obszar powinien być również dobrze wentylowany. Mechanizm wentylacyjny powinien być odporny na eksplozje w przypadku występowania wybuchowych stężeń substancji chemicznej. Powinien być również zapewniony lokalny system wyciągowy.
.