Zobacz ostatnie artykuły
27-letnia kobieta z wywiadem miażdżycowej choroby układu sercowo-naczyniowego i przebytym zawałem serca, astmą i prowokowaną zakrzepicą żył głębokich (zakończona antykoagulacja) zgłosiła się z dolegliwościami w postaci nasilającego się od dwóch dni bólu w klatce piersiowej i duszności. Zaprzeczała gorączce, dreszczom, kaszlowi produktywnemu i kontaktom z chorymi. Przyznała się do niezamierzonej utraty masy ciała o 70 funtów w ciągu 7 miesięcy, zmniejszonego apetytu, nocnych potów, biegunki i kołatania serca.
Objawy życiowe wykazały tętno 95, ciśnienie krwi 113/74 mmHg, częstość oddechów 14, SpO2 95% na powietrzu w pomieszczeniu. Pełny panel metaboliczny i pełna morfologia krwi były w normie. EKG wykazało normalny rytm zatokowy z przerostem lewej komory i bez zmian ST. Badanie moczu na obecność narkotyków było pozytywne tylko dla kannabinoidów. Markery sercowe były negatywne. TSH wynosiło 0,01 mclU/mL (0,31-5,00 mclU/mL).
Dzień 1 w szpitalu: RTG klatki piersiowej wykazało małe zagęszczenie wystające ponad prawe górne płuco na skrzyżowaniu przednich 3. i tylnych 6. żeber. Dalsze badania angiogramem CT płuc wykazały nieokreśloną jednorodną litą masę w śródpiersiu przednim górnym wzdłuż łuku aorty o wymiarach około 5,5 cm x 5,3 cm x 2,4 cm w wymiarze czaszkowo-kaudalnym, poprzecznym i AP. Masa nie miała ciągłości z tarczycą, nie wykazywała elementów torbielowatych ani zwapniałych. W badaniu tomografii komputerowej stwierdzono tyreomegalię bez zmian ogniskowych. Serce było prawidłowej wielkości, bez wysięku w osierdziu i zapadniętej żyły głównej dolnej. USG tarczycy ujawniło obustronną tyreomegalię z nadmiernym unaczynieniem i brakiem dyskretnych guzków.
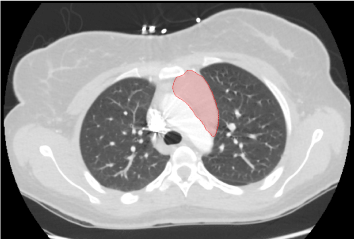
Rycina 1. Pośrednia jednorodna lita masa w śródpiersiu górnym o wymiarach 5,5 cm x 5,3 cm x 2,4 cm.
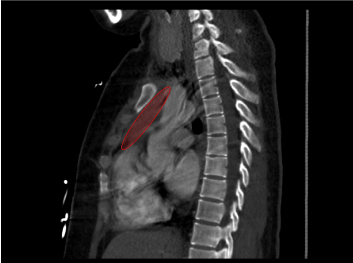
Rycina 2. Przedstawienie masy w projekcji strzałkowej.
Rysunek 3. Zapadnięta IVC bez cech wysięku osierdziowego.
Dzień 2 w szpitalu: Ze względu na podejrzenie chłoniaka lub grasiczaka skonsultowano się z radiologiem interwencyjnym i onkologiem w celu uzyskania biopsji masy śródpiersia przedniego do dalszej oceny.
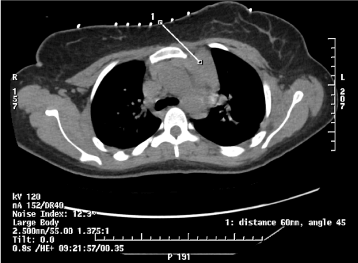
Ryc. 4. Biopsja rdzeniowa 18-gauge pod kontrolą CT w celu uzyskania nieprawidłowej gęstości tkanki miękkiej w przednim lewym górnym śródpiersiu.
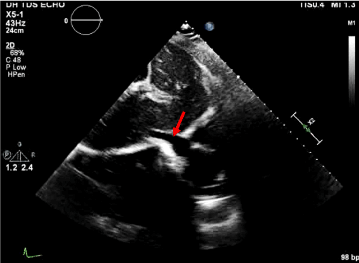
Krótko po powrocie z biopsji igłowej masy śródpiersia pod kontrolą CT, u pacjenta wystąpiły nudności, obfite wymioty i brak reakcji. Po przybyciu zespołu szybkiego reagowania parametry życiowe wynosiły: tętno 150, ciśnienie tętnicze 65/50 mmHg, RR 20, SpO2 95% na 6 L tlenu. EKG wykazało tachykardię zatokową bez zmian ST. Pacjentowi podano 1 L soli fizjologicznej w bolusie oraz przygotowano w trybie pilnym koncentrat krwinek czerwonych z obawy o uszkodzenie tętnicy płucnej jako powikłanie biopsji. Przyłóżkowe badanie ultrasonograficzne ujawniło wysięk w osierdziu, niekolapsującą żyłę główną dolną oraz współzależność komór, co wskazuje na fizjologię tamponady. Pacjentka została zaintubowana w celu zabezpieczenia dróg oddechowych, a kardiochirurgia została skonsultowana w trybie pilnym w celu wykonania perikardiocentezy i ewakuacji podejrzanego krwiaka śródpiersia. Badanie RTG klatki piersiowej potwierdziło znaczne poszerzenie śródpiersia z podejrzeniem krwiaka śródpiersia .
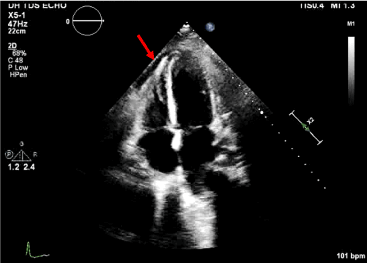
Ryc. 5. Widok osiowy 4-komorowy z wysiękiem osierdziowym.
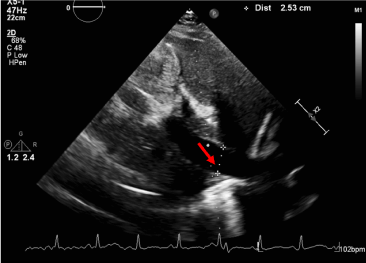
Rysunek 6. Niepowiększona żyła główna dolna. Obecność poszerzonej żyły głównej dolnej z mniej niż 50% zapadnięciem przy wymuszonym wdechu koreluje z podwyższonym ośrodkowym ciśnieniem żylnym i potwierdza fizjologię tamponady.
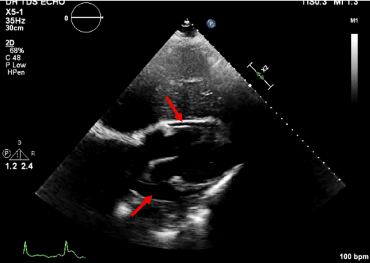
Ryc. 7. Widok podżebrowy z wysiękiem osierdziowym.
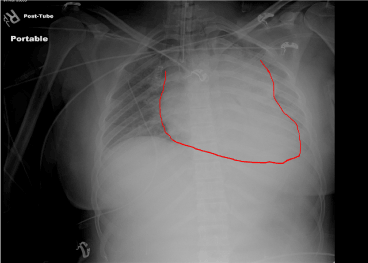
Rysunek 8. Zdjęcie rentgenowskie po intubacji. Rurka dotchawicza w pozycji. Poszerzone śródpiersie podejrzane o krwiaka śródpiersia.
Przegląd badań laboratoryjnych po przeniesieniu pacjenta na oddział intensywnej terapii wykazał TSH 0,01 mclU/mL (0,31-5,00 mclU/mL) z odruchowym wolnym T4 > 4,2 ng/dL (0,7-1,7 ng/dL) i T3 > 651 (71-170ng/dL). Wynik badania Acetylcholine Receptor Binding Antibody był ujemny. Burch-Wartofsky score > 45, klasyfikując pacjenta jako osobę z burzą tarczycową.
Wykonano zwiadowczą sternotomię pośrodkową, podając śródoperacyjnie propylotiouracyl, bursztynian sodowy hydrokortyzonu i roztwór jodu lugola. Po zbadaniu śródpiersia stwierdzono dużą masę śródpiersia przedniego z krwotokiem, którą usunięto. Stwierdzono penetrację ściany osierdzia, ewakuowano 150 cm3 krwi i skrzepu. Do każdej jamy opłucnej założono proste dreny piersiowe. Pacjenta przekazano z powrotem na OIT w stanie stabilnym.
W badaniu patologicznym masy w śródpiersiu przednim stwierdzono grasicę dwurożną o masie 90,8 g. Analiza histologiczna biopsji tkankowej masy śródpiersia wykazała łagodną hiperplazję grasicy, prawdopodobnie wtórną do nieleczonej nadczynności tarczycy.
Pacjentka została wypisana do domu w stanie stabilnym z propranololem, propylotiouracylem i zaleceniem obserwacji endokrynologicznej.
Dyskusja
Biopsja śródpiersia pod kontrolą obrazu jest ogólnie bezpieczną i minimalnie inwazyjną procedurą. Istnieje wiele podejść i różnorodnych technik obrazowania – najczęściej stosowane są ultrasonografia i tomografia komputerowa (CT). Technika obrazowania jest wybierana na podstawie określonych cech: okoliczności klinicznych, umiejscowienia masy, wielkości masy i warunków leżących u podstaw biopsji. Aspekty anatomiczne i techniczne, komponenty naczyniowe/ narządy wewnętrzne, wybór igły i względy patologiczne są rozważane przed wyborem podejścia.
Bezpośrednie podejścia śródpiersiowe obejmują podejścia parawerbalne, nadmostkowe, przezpłucne i zewnątrzopłucnowe. Przezskórna biopsja pod kontrolą tomografii komputerowej ma kilka zalet w porównaniu z innymi alternatywnymi technikami. Pozwala na precyzyjną lokalizację zmiany docelowej i dostęp do przedziałów śródpiersia, które nie są łatwo dostępne za pomocą mediastinoskopii lub biopsji endobronchialnej. Przezskórna biopsja pod kontrolą USG ma pewne zalety w porównaniu do biopsji pod kontrolą TK, przede wszystkim może być wykonywana w czasie rzeczywistym z ciągłym monitorowaniem igły podczas przesuwu i pobierania próbek. Wiele skośnych ścieżek jest również łatwo dostępnych dzięki prowadzeniu za pomocą USG, a jego przenośność wskazuje na możliwość wykonywania biopsji przy łóżku chorego w stanie krytycznym. Biopsja pod kontrolą TK zapewnia szczegółowe obrazowanie i wielopłaszczyznowe reformacje, co pomaga uniknąć nakłucia struktur naczyniowych i ważnych narządów w jamie klatki piersiowej. Przezskórna przezklatkowa biopsja igłowa pod kontrolą TK jest mniej inwazyjna niż mediastinoskopia i wymaga jedynie znieczulenia miejscowego. Nieliczne przeciwwskazania do wykonania przezskórnej przezklatkowej biopsji igłowej to podejrzenie torbieli wodonośnej (przeciwwskazanie bezwzględne), koagulopatia oraz poważnie upośledzona czynność płuc, w tym rozedma pęcherzykowa, nadciśnienie płucne lub guz naczyniowy .
U naszej pacjentki rozpoznano masę śródpiersia przedniego zlokalizowaną w lewej okolicy przymostkowej i zausznej. W przypadku masy śródpiersia przedniego lub środkowego u chorego bez przeciwwskazań najczęściej stosuje się podejście przymostkowe z przewodnictwem TK. W podejściu przymostkowym igłę wprowadza się przez mięśnie przymostkowe i tłuszcz śródpiersia do zmiany docelowej. Pomiędzy kolejnymi ruchami igły wykonywane są wielokrotne skany w celu sprawdzenia trajektorii, aby upewnić się, że wewnętrzne naczynia sutkowe nie znajdują się na drodze. Igła o średnicy 22 mm może być użyta do wstrzyknięcia roztworu soli fizjologicznej lub rozcieńczonego środka kontrastowego, aby poszerzyć śródpiersie i stworzyć sztuczną drogę pozapiórkową do umieszczenia igły. Po wytworzeniu bezpiecznego okna pozapłucnego usuwa się igłę o rozmiarze 22 i wprowadza się igłę prowadzącą o dużym otworze (18 lub większym). Stosując technikę współosiową, aspiracja cienkoigłowa i biopsja rdzeniowa są wykonywane przez igłę prowadzącą.
Częste powikłania biopsji śródpiersia obejmują reakcje wazowagalne, zatorowość powietrzną i wysiew guza. Poważne powikłania biopsji masy śródpiersia pod kontrolą tomografii komputerowej są nietypowe, a zgony zdarzają się bardzo rzadko. Najczęstszym zagrażającym życiu powikłaniem biopsji śródpiersia jest odma opłucnowa, której częstość występowania po biopsji waha się od 27% do 54%. Duża retrospektywna seria badań wykazała, że częstość występowania odmy opłucnowej wynosi 20,5%, a częstość występowania odmy wymagającej drenażu klatki piersiowej 3,1%. Inne powikłania to krwotok płucny z krwiopluciem lub bez, odma opłucnowa i krwiak ściany klatki piersiowej. W przypadku hemothorax zaleca się drenaż klatki piersiowej w fazie ostrej, a następnie terapię lityczną w fazie podostrej. Weinberg i wsp. dokonali przeglądu 830 biopsji klatki piersiowej z lat 2006-2011 i stwierdzili, że u 4 z 830 (0,5%) pacjentów w wieku 33-71 lat rozwinęła się odma opłucnowa po biopsji. Żaden z pacjentów nie miał nieprawidłowych wartości koagulacji ani liczby płytek krwi, a co warte podkreślenia, u jednego z nich objawy pojawiły się ponad 12 godzin później. Tomiyama i wsp. w badaniu przeprowadzonym w japońskich szpitalach stwierdzili, że tylko 0,092% przezskórnych biopsji płuc spowodowało wystąpienie odmy opłucnowej. Yeowet, et al. zgłosił, że tylko 1 z 680 (0,2%) biopsji współosiowych miała powikłanie w postaci odmy opłucnowej.
Krwawienie było zgłaszane jako występujące ze źródła płucnego lub uszkodzenia tętnicy międzyżebrowej. W żadnym przypadku nie odnotowano uszkodzenia osierdzia, co skutkowało tamponadą serca.
W naszym przypadku u pacjenta rozwinęła się tamponada serca wynikająca z hemopericardium, co jest rzadko zgłaszanym powikłaniem biopsji śródpiersia. Postulujemy, że igła w naszym przypadku utworzyła małe rozdarcie w naczyniu płucnym i spowodowała komunikację między tętnicą płucną a osierdziem podczas pobierania tkanki. Na szczęście diagnoza została postawiona szybko i pacjent został poddany eksploracyjnej sternotomii śródpiersia.
Wniosek
Biopsja przezskórna sterowana obrazem jest rutynowo stosowana w diagnostyce zmian w śródpiersiu. Tomografia komputerowa (CT) i ultrasonografia służą do precyzyjnej lokalizacji zmiany docelowej. Obrazowanie TK jest uznawane za najlepszą metodę obrazowania do prowadzenia biopsji igłowej. Czynniki wpływające na decyzję o wyborze odpowiedniego podejścia obejmują okoliczności kliniczne, lokalizację, wielkość zmiany docelowej i choroby współistniejące. Najlepsze podejście do biopsji przezskórnej powinno być zidentyfikowane poprzez przegląd wcześniejszych obrazów i wywiadu. Należy pamiętać, że ryzyko powikłań może się różnić w zależności od rodzaju metody. Pomimo wysokiej dokładności diagnostycznej i rzadkiego występowania powikłań, konieczne jest określenie najbezpieczniejszego dostępu i zachowanie czujności w przypadku wystąpienia jakichkolwiek powikłań oraz zapewnienie szybkiego leczenia, gdy jest to wskazane.
- Gupta S, Seaberg K, Wallace M (2005) Imaging-guided percutaneous biopsy of mediastinal lesions: different approaches and anatomic considerations. Radiographics 25: 763-786.
- Kulkarni S, Kulkarni A, Roy D, Thakur MH (2008) Percutaneous computed tomography-guided core biopsy for the diagnosis of mediastinal masses. Annals of Thoracic Medicine 3: 13-17.
- Westcott JL (1988) Percutaneous transthoracic needle biopsy. Radiology 169: 593-601.
- Langen HJ, Klose KC, Keulers P, Adam G, Jochims M, Gunther RW (1995) Artificial widening of the mediastinum to gain access for extrapleural biopsy: clinical results. Radiology 196: 703-706.
- Hira L, Neyaz Z, Nath A, Borah S (2012) CT-guided percutaneous biopsy of intrathoracic lesions. Korean J Radiol 13: 210-226.
- Bressler EL, Kirkham JA (1994) Mediastinal masses: Alternative approaches to CT- guided needle biopsy. Radiology 191: 391-396.
- Richardson CM, Pointon KS, Manhire AR, Macfarlane JT (2002) Percutaneous lung biopsies: a survey of UK practice based on 5444 biopsies. Br J Radiol 75: 731-735.
- Weinberg, B, Watumull, L, Landay M, Omar, H (2013) Variable presentations of thoracic biopsy related hemothorac. Universal Journal of Clinical Medicine 1: 22-27.
- Tomiyama N, Yasuhara Y, Nakajima Y, Adachi S, Arai Y, Kusumoto M, et al. (2006) CT-guided needle biopsy of lung lesions: a survey of severe complication based on 9783 biopsies in Japan. European Journal of Radiology 59: 60-64.
- Protopapas Z, Westcott JL (2000) Transthoracic hilar and mediastinal biopsy. Radiol Clin North Am 38: 281-289.