Aplastic anemia pathophysiology
Aplastic anemia Microchapters
Home
Patient Information
Overview
Historical Perspective
Classification
Pathophysiology
Causes
Differentiating Aplastisk anæmi fra other Diseases
Epidemiology and Demographics
Risk Factors
Screening
Natural History, Complications and Prognosis
Diagnosis
Diagnostic Study of Choice
History and Symptoms
Physical Examination
Laboratory Findings
Electrocardiogram
Chest X Ray
CT
MRI
Echocardiography or Ultrasound
Other Imaging Findings
Other Diagnostic Studies
Treatment
Medical Therapy
Surgery
Primary Prevention
Secondary Prevention
Cost-Effectiveness of Therapy
Future or Investigational Therapies
Case Studies
Case #1
Aplastic anemia pathophysiology On the Web
Most recent articles
cited articles
Review articles
CME Programs
Powerpoint slides
Billeder
American Roentgen Ray Society Billeder af Aplastisk anæmi patofysiologi
Alle billeder X-rays Echo & Ultralyd CT-billeder MRI
Påbegyndte forsøg på Kliniske Forsøg.gov
US National Guidelines Clearinghouse
NICE Guidance
FDA om patofysiologi for aplastisk anæmi
CDC om patofysiologi for aplastisk anæmi
Aplastisk anæmi patofysiologi i nyhederne
Blogs om Aplastisk anæmi patofysiologi
Vejledning til hospitaler Behandling af aplastisk anæmi
Risikokalkulatorer og risikofaktorer for Aplastisk anæmi patofysiologi
Redaktør-In-Chief: C. Michael Gibson, M.S., M.D. ; Medredaktør(er)-hovedredaktør(er): C. Michael Gibson, M.S., M.D. ; Medredaktør(er)-chef: Priyamvada Singh, M.D. Nazia Fuad M.D.
Hjælp venligst WikiDoc ved at tilføje indhold her. Det er nemt! Klik her for at lære om redigering.
Overblik
Knoglermarv er et svampet væv, som findes i de svampede eller spongiøse dele af knogler. Det er højt vaskulariseret og rigt innerveret Knoglemarv er det primære sted for hæmatopoiese og består af hæmatopoietiske celler, marvfedtvæv og stromale celler. Det mest defensive træk i patofysiologien ved aplastisk anæmi er tab af hæmatopoietiske stamceller. Det kan være i form af hæmatopoietisk svigt eller immunmedieret destruktion af knoglemarven. Lægemidler, kemikalier, vira og forskellige former for mutationer ændrer HSC’ernes immunologiske udseende, hvilket resulterer i autoimmun ødelæggelse af knoglemarvsceller. AA kan gradvist udvikle sig til andre hæmatologiske lidelser, herunder paroxysmal natlig hæmoglobinuri, myelodysplastiske syndromer og akut myeloid leukæmi.) Klonudvikling i AA kan ske på grund af mutationer eller cytogenetiske abnormiteter. De gener, der almindeligvis er muterede, er DMNT3A, ASXL1, BCOR, BCORL1 og PIGA.
Patofysiologi
Fysiologi
Den normale fysiologi i knoglemarv kan forstås som følger:
- Knoglermarven er et svampet væv, der findes i de svampede eller spongiøse dele af knoglerne
- Det er stærkt vaskulariseret og rigt innerveret
- Knoglermarven er det primære sted for hæmatopoiesen.
- Den består af hæmatopoietiske celler, marvfedtvæv og stromale celler.
- Hæmatopoietiske stamceller (HSC) i knoglemarven er kilden til alle modne celler i det perifere blod og væv og er multipotente.
- HSC genkendes og isoleres i henhold til deres immunofænotype.
- HSC udgør en lille population inden for CD34+/CD38-fraktionen af knoglemarvsceller.
- Hæmatopoiesen styres af forskellige reguleringsmekanismer, herunder vækstfaktorer.
- Den normale knoglemarvsstruktur kan blive beskadiget eller forskudt ved aplastisk anæmi, maligniteter eller infektioner.
- Dette fører til en nedsat produktion af blodceller og blodplader.
Patogenese
Det mest defenitive træk i patofysiologien ved aplastisk anæmi er tab af hæmatopoietiske stamceller.
Patofysiologiske mekanismer, der resulterer i tab af HSC’er og forårsager aplastisk anæmi, omfatter:
Hæmopoietisk svigt
- CD34-celler er næsten fraværende aplastisk anæmi.
- Progenitorceller, der er i stand til at danne erythroide, myeloide og megakaryocytære celler, er stærkt reduceret.
- De primitive hæmatopoietiske celler, som er nært beslægtet med stamceller, er konsekvent mangelfulde.
- De hvide blodlegemer i aplastisk anæmi har korte telomerer.
- Telomerer er gentagelser i enden af eukaryote kromosomer og er essentielle for kromosombeskyttelse og fuldstændig DNA-replikation.
Immunmedieret T-celle-destruktion af marv
-
- Lægemidler, kemikalier, vira og forskellige former for mutationer ændrer HSC’ernes immunologiske udseende, hvilket resulterer i autoimmun destruktion af marvceller.
- I patienter med erhvervet aplastisk anæmi er lymfocytter ansvarlige for ødelæggelsen af de hæmatopoietiske celler.
- Disse T-celler producerer en hæmmende faktor, interferoner , tumor necrosis faktor og interleukin-2, hvilket resulterer i hæmatopoietisk celledød ved apoptose.
- CD4+CD25+FOXP3+ regulatoriske T-celler er mangelfulde hos disse patienter, svarende til det, der ses ved andre autoimmune tilstande.
- Mangel på disse regulatoriske T-celler resulterer i stigning i T-bet-proteinniveauet i T-celler, øget interferon (IFN)-γ,2 og stamcelledestruktion.
- Forhøjet immunrespons, herunder tumor necrosis factor -α, IFNγ og interleukin-6, er også meget almindeligt hos AA-patienter.
Klonale udvikling
- AA kan gradvist udvikle sig til andre hæmatologiske lidelser, som omfatter
-
- Paroxysmal nocturnal hæmoglobinuri
- Myelodysplastiske syndromer
- Akut myeloid leukæmi
- Klonale udvikling i AA kan forekomme på grund af mutationer eller cytogenetiske abnormiteter.
- De gener, der almindeligvis findes muterede, er
- DMNT3A
- ASXL1
- BCOR
- BCORL1
- PIGA
Genetik
Generne, der er involveret i patogenesen af aplastisk anæmi, omfatter:
- HLA-DR15
- CD4+ CD25+ FOXP3+ regulatoriske T-celler
- STAT3
- TERT
- TERC
Associerede tilstande
Aplastisk anæmi er associeret med følgende tilstande:
- Fanconi’s anæmi
- PNH Paroxysmal Nocturnal Hemoglobinuria
Gross Patologi
Aplastisk anæmi har ikke nogen grov patologi
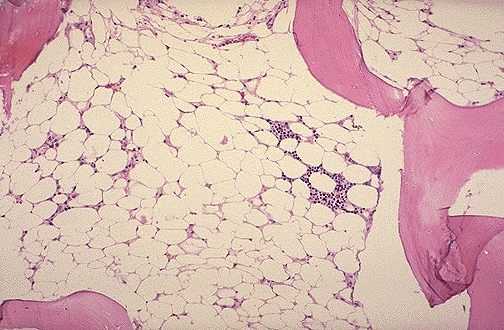
Mikroskopisk patologi
Ved aplastisk anæmi afslører knoglemarvsmikroskopi hypo- og endog acellularitet, fedtvæv og blegt stroma.
- Hays K (februar 1990). “Fysiologi af normal knoglemarv”. Semin Oncol Nurs. 6 (1): 3-8. PMID 2406826.
- Bacigalupo A (2007). “Aplastisk anæmi: patogenese og behandling”. Hæmatologi Am Soc Hematol Educ Program: 23–8. doi:10.1182/asheducation-2007.1.23. PMID 18024605.
- 3.0 3.1 3.1 3.2 3.3 Brodsky, R. A. (2000). “Aplastisk anæmi: Patofysiologi og behandling”. Journal of the National Cancer Institute. 92 (9): 754-754. doi:10.1093/jnci/92.9.754. ISSN 1460-2105.
- 4.0 4.1 Young, Neal S. (2002). “Erhvervet aplastisk anæmi”. Annals of Internal Medicine. 136 (7): 534. doi:10.7326/0003-4819-136-7-20020402020-00011. ISSN 0003-4819.