Atome
Fakten, Zusammenfassung & Definition
- Atome sind die kleinste Einheit der Materie und verbinden sich zu Molekülen
- Sie enthalten Protonen, Neutronen, und Elektronen
- Mehr als 99% eines Atoms sind leerer Raum, aber Elektronen stoßen die Atome ab
- Die Anzahl der Protonen in einem Atom bestimmt seine Ordnungszahl
- Die Anzahl der Protonen und Neutronen bestimmt seine Atommasse
Was sind Atome?
Atome sind die kleinste Einheit der Materie (etwas, das physisch berührt werden kann), die alle chemischen Eigenschaften eines Elements beibehält. Sie verbinden sich zu Molekülen (die wiederum feste, gasförmige und flüssige Stoffe bilden).
Atomteilchen
Atome bestehen aus drei Grundteilchen. Diese sind Elektronen, Protonen und Neutronen – sie werden zusammen als subatomare Teilchen bezeichnet.
Der Atomkern enthält sowohl Protonen (positiv geladene Teilchen) als auch Neutronen (ungeladene Teilchen). Diese Protonen und Neutronen werden gemeinsam als Nukleonen bezeichnet und sind durch eine Kraft miteinander verbunden, die als starke Restkraft bezeichnet wird. Die Anzahl der Neutronen im Verhältnis zur Anzahl der Protonen bestimmt die Stabilität des Kerns.
Um den Kern herum befinden sich Elektronenhüllen, die die Elektronen (negativ geladene Teilchen) enthalten. Die Eigenschaften eines Atoms hängen von der Anzahl und der Anordnung aller Teilchen ab.
Elektronen sind die kleinsten der subatomaren Teilchen (sie sind zu klein, um mit den Techniken, die den Wissenschaftlern derzeit zur Verfügung stehen, gemessen zu werden) und haben eine negative Ladung. Sie sind aufgrund ihrer entgegengesetzten elektrischen Ladung an den Atomkern gebunden. Wenn ein Atom entweder mehr oder weniger Elektronen als seine Ordnungszahl hat, wird das Atom geladen und als Ion bezeichnet – hat das Atom mehr Elektronen, wird es negativer; hat das Atom weniger Elektronen, wird es positiver. Elektronen haben keine innere Struktur und werden daher als Elementarteilchen bezeichnet.
Protonen besitzen eine positive Ladung und sind 1836-mal schwerer als ein Elektron. Die Anzahl der Protonen in einem Atom ist gleich der Ordnungszahl. Jedes Proton besteht aus zwei up-Quarks und einem down-Quark – diese sind eine Art Elementarteilchen. Quarks werden durch eine Kraft zusammengehalten, die starke Wechselwirkung genannt wird – diese starke Wechselwirkung wird durch Gluonen (eine andere Art von Elementarteilchen) vermittelt.
Neutronen sind die schwersten subatomaren Teilchen und wiegen 1839 Mal mehr als ein Elektron. Sie besitzen überhaupt keine Ladung. Jedes Neutron besteht aus einem up-Quark und zwei down-Quarks.
Das folgende Bild zeigt den Aufbau eines Atoms. Du kannst den Kern und die Elektronenhüllen sehen:
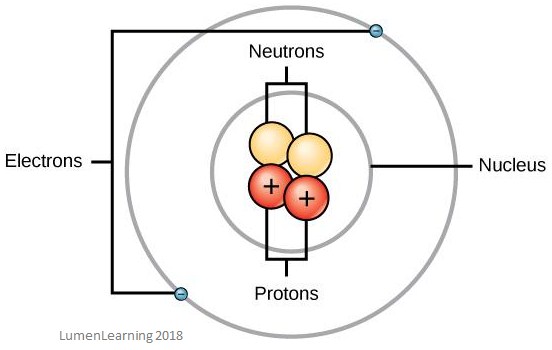
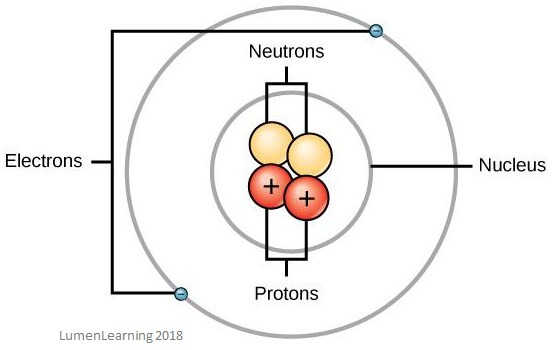
Atomische Masse
Protonen und Neutronen haben die gleiche Masse von 1,67 × 10-24 Gramm – Wissenschaftler definieren diese Menge gewöhnlich als ein Dalton. Während sie eine ähnliche Masse haben, besitzen Neutronen keine Ladung (Protonen hingegen schon). Das bedeutet, dass Neutronen stark zur Masse eines Atoms beitragen, aber nicht zu seiner Ladung.
Elektronen sind viel kleiner und wiegen nur 9,11 × 10-28 Gramm – das bedeutet, dass sie nicht wesentlich zur Masse eines Atoms beitragen, sondern aufgrund seiner Ladung.
Die folgende Tabelle zeigt die Lage, Masse und Ladung aller Teilchen, die sich in einem Atom befinden.
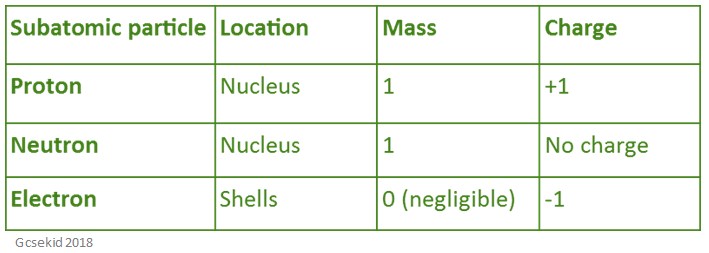
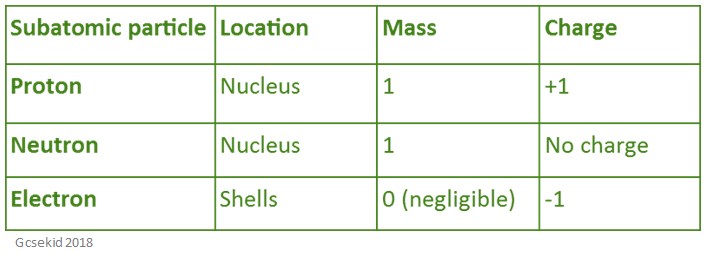
Atomvolumen
Mehr als 99% eines Atoms ist leerer Raum. Der Grund dafür, dass Objekte nicht einfach aneinander vorbeigehen, liegt an den Elektronen. Die Elektronen, die jedes Atom umgeben, sind negativ geladen und stoßen sich daher gegenseitig ab, wenn sie in die Nähe kommen. Dadurch wird verhindert, dass Atome den gleichen Raum einnehmen.
Atomzahl
Die Anzahl der Protonen in einem Atom bestimmt seine Atomzahl – diese wird gewöhnlich mit Z bezeichnet. Dieser Wert ändert sich nie, es sei denn, der Kern zerfällt irgendwie oder der Kern wird beschossen (Kernphysik). Kohlenstoff hat zum Beispiel die Ordnungszahl 6, weil er 6 Protonen hat. Mit Hilfe der Ordnungszahl lassen sich die Elemente voneinander unterscheiden. Die Anzahl der Elektronen in einem Atom entspricht immer der Anzahl der Protonen – dies erklärt, warum Atome keine Gesamtladung haben.
Massenzahl
Die Gesamtzahl der Protonen und Neutronen in einem Atom bestimmt seine Massenzahl – diese wird normalerweise mit A bezeichnet. Elektronen werden bei der Berechnung der Masse eines Elektrons normalerweise nicht berücksichtigt, da ihre Masse so vernachlässigbar ist. Die Anzahl der Neutronen in einem Element lässt sich mit der folgenden Gleichung berechnen:
Massenzahl – Anzahl der Protonen = Anzahl der Neutronen
Isotope desselben Elements haben die gleiche Ordnungszahl, aber eine unterschiedliche Massenzahl – dies liegt daran, dass sie eine unterschiedliche Anzahl von Neutronen haben können. Die meisten Elemente haben viele natürlich vorkommende Isotope. Sie müssen auch wissen, dass die Atommasse eines Elements dem Durchschnitt der relativen Häufigkeit aller seiner Isotope entspricht. Kohlenstoff hat zum Beispiel drei Isotope, aber da Kohlenstoff-12 etwa 99% des gesamten Kohlenstoffs ausmacht, hat Kohlenstoff die Atommasse 12.
Weiter lesen
http://www.chem4kids.com/files/atom_structure.html
https://www.livescience.com/37206-atom-definition.html
http://www2.open.ac.uk/openlearn/periodictablephase2/atom.html
https://chem.libretexts.org/Textbook_Maps/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Atomtheorie/Isotope