JOP. Journal of the Pancreas
Ampulliaariset adenoomat
Vaterin papillan kasvaimet ovat harvinaisia, ja niiden esiintyvyydeksi on raportoitu 0,04 % ± 0,12 % ruumiinavaustutkimuksissa. Niitä voi esiintyä sporadisina vaurioina tai potilailla, joilla on familiaalinen adenomatoottinen polypoosi. Histologisesti hyvänlaatuisten adenoomien pahanlaatuinen muuttuminen karsinoomiksi on dokumentoitu. Raportoitu pahanlaatuisuuden esiintymistiheys papillaarisen adenooman yhteydessä vaihtelee 26-65 %:n välillä. Adenomatoottisia jäännöspesäkkeitä sekä kohtalaisen tai vaikean dysplasian alueita on löydetty myös jopa 90 prosentissa suurten papillojen karsinooman resektionäytteistä. Näiden havaintojen perusteella ison tai pienen papillan adenoomilla ajatellaan olevan sama adenooma-karsinooma-sekvenssi kuin paksusuolen adenoomilla .
Näistä syistä näiden leesioiden täydellinen poisto on pakollinen, mutta valittu hoito on edelleen kiistanalainen.
Kirurgia edustaa perinteistä vaihtoehtoa, mukaan lukien haimanoduodenektomia, jonka perioperatiivinen kuolleisuus on 2-9 % ja jonka postoperatiivisten komplikaatioiden osuus on hyvin merkittävä (jopa 41 % suuressa sarjassa), ja duodenotomia, johon liittyy paikallinen poisto; jälkimmäinen on varmasti vähemmän invasiivinen, mutta siihen liittyy paikallinen uusiutuminen.
Vähäisen sairastuvuuden ja kuolleisuuden vuoksi endoskooppinen hoito on siis saavuttanut yhä enemmän yksimielisyyttä ensisijaisena hoitomuotona, vaikka näiden leesioiden vaikea anatominen sijainti tekeekin resektiosta paljon monimutkaisemman toimenpiteen verrattuna paksusuolen polypektomiaan ; lisäksi leikkauskelpoisten potilaiden myöhempää kirurgista hoitoa ei estä aikaisempi endoskooppinen resektio.
Preoperatiivinen arviointi: How to Choose the Treatment?
Pelkästään endoskooppisen ulkonäön perusteella ampullaarisia adenoomia ei aina voida erottaa ampullaarisista karsinoomista tai ei-adenomaattisista polyypeistä (karsinoidikasvaimet, gangliosyyttiset paraganglioomat jne.).
Siten lopullinen kudosdiagnoosi on asianmukaisen hoidon ennakkoedellytys, mutta tietyssä prosenttimäärässä tapauksia pinsettibiopsiat eivät anna mahdollisuutta oikeaan kudosbiopsiaan.
Tämän vaikeuden voittamiseksi eräät kirjoittajat ehdottavat, että ampullektomiaa käytettäisiin laajemmin diagnostisesti ja terapeuttisesti pihtibiopsian sijasta: histologisten näytteiden laatu voi olla parempi, patologinen diagnoosi tarkempi ja uusien koepalojen tarve huomattavasti pienempi .
Toinen tärkeä staging-kohde on sappiteiden ja/tai haiman intraduktaalisen kasvun arviointi, jota monet kirjoittajat ovat pitäneet endoskooppisen hoidon vasta-aiheena; siksi endoskooppinen retrogradinen kolangiopankreatografia (ERCP) sivulle katsovalla duodenoskoopilla on tarpeen kaikilla potilailla, jotta ennen resektiota saataisiin sekä sappitiekuvaus (cholangiogrammi) että haimatulehduskuvaus (pancreatogrammi), joilla voidaan osoittaa kasvaimen mahdollinen intraduktaalinen laajeneminen.
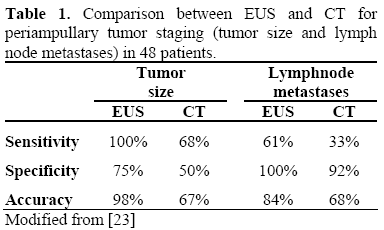
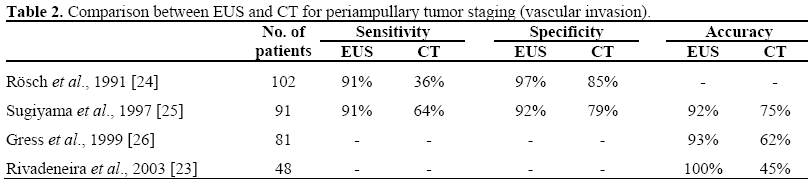
ERCP:n lisäksi voidaan tehdä endoskooppinen ultraäänitutkimus (EUS) ja/tai intraduktaalinen ultraäänitutkimus (IDUS), jotta saadaan yksityiskohtaisempaa ja tarkempaa tietoa papillaarisen leesion laajuudesta, kuten kasvaimen koosta ja kaikuvuudesta, pohjukaissuolen seinämän kerroksellisista rakenteista ja alueellisesta imusolmuketilanteesta. Kirjallisuudessa raportoidut tiedot ovat osoittaneet, että lineaarinen EUS on parempi kuin spiraalinen CT kasvaimen koon preoperatiivisessa arvioinnissa, alueellisten solumetastaasien havaitsemisessa ja merkittävän vaskulaarisen invaasion havaitsemisessa potilailla, joilla on periampulliaarisia pahanlaatuisia kasvaimia. Lineaarinen EUS on parantanut periampullariaalisten pahanlaatuisten kasvainten preoperatiivista paikallista vaiheistusta, kun tapauksia verrattiin leikkauslöydösten perusteella (taulukot 1 ja 2).
Ei ole yksimielisyyttä siitä, mitkä ampullaariset adenoomat olisi pidettävä seurannassa ja mitkä leesiot olisi poistettava endoskooppisesti tai kirurgisesti.
Monet kirjoittajat ovat kannattaneet sitä, että endoskooppinen resektio olisi tehtävä vain potilaille, joilla ei ole näyttöä invasiivisesta syövästä. Toisten kirjoittajien mielestä endoskooppinen resektio ei ole kontraindisoitu edes silloin, kun on näyttöä korkea-asteisesta dysplasiasta.
Taulukossa 3 esitetään kirjallisuudessa yleisimmin raportoidut endoskooppisen resektiokelpoisuuden kriteerit. On huomattava, että sisäänottokriteereissä on huomattavaa vaihtelua. Jotkut kirjoittajat sulkevat yli 4-4,5 cm:n suuruiset leesiot paikallisen resektion ulkopuolelle, kun taas toiset sisällyttävät ne; osittaisen resektion soveltaminen tarvittaessa on osaltaan lisännyt hoidettujen leesioiden kokoa: esimerkiksi halkaisijaltaan jopa 7 cm:n suuruisia kasvaimia on resekoitu onnistuneesti.

Kriittistä seikkaa edustaa kuitenkin ampulliaaristen adenoomien histologinen staging. Yleensä paikallinen poisto on hyväksytty kuratiivinen hoito adenoomalle, jossa on korkea-asteinen intraepiteelinen neoplasia/tumor in situ (HGIN/Tis). T1-syövässä, joka määritellään TNM-luokituksen mukaan kasvaimeksi, joka rajoittuu ampullan tai Oddin sulkijalihaksen alueelle, on lymfovaskulaarista invaasiota tai imusolmukemetastaaseja ja duktaalista osallistumista 10-50 prosentissa tapauksista ja 20-40 prosentissa tapauksista. Näin ollen tässä tapauksessa on suurempi mahdollisuus epätäydelliseen resektioon ja/tai syövän uusiutumiseen; samoin kuin paksusuolen adenoomien hoidossa, endoskooppinen ampullektomia voi olla parantava T1-syövän hoidossa, jossa ei ole lymfovaskulaarista invaasiota, jos koko resekoidun näytteen histologinen tutkimus vahvistaa täydellisen poiston.
Tämän lisäksi toinen tärkeä näkökohta on intraduktaalinen kasvain, jota voi esiintyä sekä Tis- että T1-adenoomassa, ja myös matala-asteisessa displasiassa olevissa adenoomissa. Bohnacker ym. ehdottavat, että leikkausta suositellaan, jos intraduktaalikasvua esiintyy Tis:ssä ja T1:ssä; adenoomissa, joissa on matala-asteinen dysplasia, jos intraduktaalikasvu on pienempi kuin 1 cm, on edelleen mahdollista valita endoskooppinen resektio. Leikkaus jää joka tapauksessa ainoaksi vaihtoehdoksi, jos poisto on epätäydellinen ja jos pahanlaatuisuutta esiintyy selvästi .
Kuvassa 1 on esitetty mahdollinen vuokaavio hoitovaiheiden suuntaamiseksi.
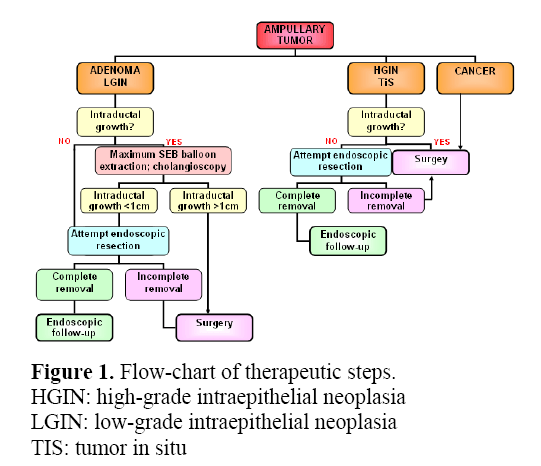
Kuvio 1. Leikkaus. Hoitovaiheiden vuokaavio.
HGIN: korkea-asteinen intraepiteliaalinen neoplasia
LGIN: matala-asteinen intraepiteliaalinen neoplasia
TIS: tumor in situ
Sukulaisperäisen adenomatoottisen polypoosin esiintyessä on annettava joitakin suosituksia. Näille potilaille kehittyy hyvin usein adenoomia pohjukaissuolen toiseen osaan, mukaan lukien Vaterin papilla, mutta haimanoduodenektomia ei ole aina pakollinen.
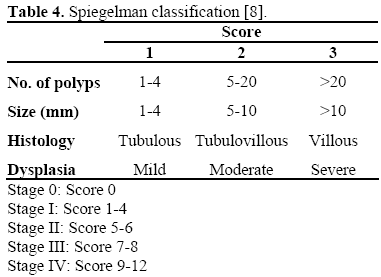
Syöpäriskiä arvioidaan Spigelmanin luokituksen avulla (taulukko 4) . Noin 10-30 %:lle potilaista, joilla on familiaalinen adenomatoottinen polypoosi, kehittyy Spigelmanin asteen IV duodenaalinen adenomatoosi; koodonin 1051 jälkeiset mutaatiot näyttävät liittyvän vakaviin periampullarisiin vaurioihin . Näillä potilailla on 30-40 %:n kumulatiivinen syöpäriski, ja ennaltaehkäisevää pancreaticoduodenektomiaa olisi sen vuoksi harkittava.
Endoskooppinen hoito voidaan suorittaa jäljellä olevissa vaiheissa (mahdollisesti yhdistettynä kemoterapiaan vaiheissa II-III), ja endoskooppista seurantaa on jatkettava tiiviisti ampullaarisen leesion täydellisen poiston jälkeen .
Endoskooppisen snare-papillektomian tekniikat
Ampullan adenoomien endoskooppisen poiston tekniikat ovat edelleen vakioimattomia, mikä johtuu luultavasti tämäntyyppisten toimenpiteiden suhteellisen pienestä määrästä On tärkeää muistaa, että termi ”ampullektomia” viittaa koko Vaterin ampullan poistoon ja on kirurginen termi toimenpiteille, jotka edellyttävät distaalisen yleisen sappitiehyen ja haimakanavan kirurgista uudelleensijoittamista pohjukaissuolen seinämän sisään.
Teknisesti, kun tehdään endoskooppisia leesioiden resektioita suuressa papillassa, vain papillan kudos voidaan poistaa endoskooppisesti, ja näin ollen termi ”papillektomia” on sopivampi kuin termi ”ampullektomia”, vaikka näitä kahta käytetään usein kirjallisuudessa vaihdellen.
Pohjukaissuolen papillat (suuret ja pienet) olisi tarkastettava sivulle katsovalla endoskoopilla (duodenoskoopilla), sillä papillaaripatologia jää helposti huomaamatta eteenpäin katsovilla välineillä. Jotkut kirjoittajat suosittelevat submukosaalista injektiota ennen resektiota, mutta sitä ei rutiininomaisesti vaadita (kuten ennen endoskooppisen limakalvoresektion suorittamista paksusuolen polyypeille). Jos leesiossa ei ilmene ”nosto-merkkiä”, se liittyy pahanlaatuisuuteen, ja monet kirjoittajat pitävät sitä vasta-aiheena täydellisen endoskooppisen resektion yrittämiselle.
Jotkut tutkijat eivät päinvastoin suosittele submukosaalista injektiota, koska leesiota voi olla vaikea saada kiinni snarrin avulla ja koska submukosaalinen injektio voi hämärtää kasvaimen reunaa eikä se nosta pohjukaissuolen seinämän läpi kulkevaa sappitiehyttä.
Endoskooppinen papillektomia suoritetaan käyttämällä endoskooppisia snarreja ja sähkökauteria. Useimmissa raporteissa on käytetty tavallisia ”punottuja” polypektomiasilmukoita, vaikka erityisesti ampullaariresektioon suunniteltuja hienolankasilmukoita on saatavilla. Ei ole näyttöä, joka osoittaisi, että jokin snarratyyppi olisi edullisempi kuin jokin toinen.
Jos leesio saadaan kokonaan ansaan, voidaan suorittaa en bloc -resektio. En bloc -resektion etuna on, että se mahdollisesti lyhentää toimenpideaikaa, vaatii vähemmän sähkökauterointia ja tarjoaa täydellisen kudosnäytteen patologista arviointia varten. Paloiteltu resektio tehdään kuitenkin usein yli 2 cm:n suuruisille leesioille tapauksissa, joissa en bloc -resektiota yritettäessä on jäänyt näkyvää kasvainkudosta paikalleen, tai rei’itysriskin minimoimiseksi. Paloiteltu resektio voi aiheuttaa patologiseen analyysiin lähetettäviin kudosfragmentteihin sähkökauteen liittyviä vammoja. Suuremmat leesiot saattavat vaatia useita endoskooppisia toimenpiteitä, jotta ne voidaan poistaa kokonaan. Useimmissa julkaistuissa tutkimussarjoissa on käytetty en bloc- ja paloitellun resektion tekniikoiden yhdistelmää, koska hoidetut leesiot olivat kooltaan ja rakenteeltaan vaihtelevia. Ei ole yksimielisyyttä siitä, minkälaista virtaa tulisi käyttää endoskooppisessa papillektomiassa. Sekä puhdasta leikkausvirtaa, sekoitusvirtaa tai endocut-virtaa on käytetty, eikä kummankaan ole tällä hetkellä osoitettu olevan toista parempi. Virta-asetuksia ei myöskään ole standardoitu .
Papillektomian jälkeen (en bloc tai kappaleittain) voidaan käyttää Nd:YAG-laseria tai argonplasmakoagulaatiota jäljelle jääneen adenomatoottisen kudoksen poistamiseen . Haiman tai sappitiehyen sfinkterotomia voi auttaa haima- ja sappitiehyen tyhjennyksen aikaansaamisessa papillektomian jälkeen ja voi yksinkertaistaa yrityksiä päästä käsiksi yleiseen sappitiehyeeseen ja haimakanavaan stentin asettamista varten. Ne voivat myös auttaa toimenpiteen jälkeisessä endoskooppisessa seurannassa.
Monissa tutkimuksissa on osoitettu, että ennaltaehkäisevän haimaputken stentin asettaminen vähentää ERCP:n jälkeisen haimatulehduksen riskiä , mikä minimoi haimaputken suuaukon ahtautumisriskin, ja se voi myös mahdollistaa turvallisemman liitännäishoitojen käytön, mutta tätä teoriaa ei ole todistettu. Toiset kannattavat haimastentin asettamista vain, jos haimatiehyt ei tyhjene papillektomian jälkeen .
Zádorová ym. tutkimuksessa haimatulehduksen osuus potilailla, joille tehtiin papillektomia haimastentin kanssa ja ilman haimastenttiä, oli 0 % ja 20 %. Monikeskustutkimuksessa todettiin, että toimenpiteen jälkeinen haimatulehdus oli yleisempi potilailla, joille ei asetettu haimastenttiä (17 % vs. 3,3 %), vaikka ero ei ollut tilastollisesti merkitsevä. Chengin ym. tutkimuksessa haimastentin ennaltaehkäisevään asettamiseen liittyi pienempi ESP:n jälkeisen haimatulehduksen määrä (9,6 % vs. 25 %; P=0,33).
Ainoassa prospektiivisessa, satunnaistetussa, kontrolloidussa tutkimuksessa, jossa arvioitiin ennaltaehkäisevän haimatiehyen stenttauksen merkitystä endoskooppisen papillektomian jälkeisen haimatulehduksen vähentämisessä, osoitettiin kuitenkin, että toimenpiteen jälkeisen haimatulehduksen määrä väheni tilastollisesti merkitsevästi stenttiryhmässä . Näiden tietojen perusteella ennaltaehkäisevää haimakanavan stenttausta papillektomian aikana suositellaan toimenpiteen jälkeisen haimatulehduksen riskin pienentämiseksi, kun taas .ei ole tietoa siitä, kuinka kauan kanava tulisi stentata.
Vaikka haimakanavan stenttauksesta käydään laajaa keskustelua, myös sappitiehyen tyhjennyksen tarpeellisuudesta papillektomian jälkeen herää kysymys. Satunnaisesti on raportoitu sappitiesten stentin asettamisesta endoskooppisen papillektomian jälkeen , ja käytetyn stentin halkaisija on vaihdellut 7 F:n ja 10 F:n välillä. Nasobiliaalinen dreeni voisi olla pätevä vaihtoehto stentille, joka mahdollistaisi sappitiehyen tyhjennyksen röntgentarkkailun muutaman päivän ajan toimenpiteen jälkeen ilman uutta endoskooppista tutkimusta.
Teoreettisesti sappitietulehdus voi ilmetä endoskooppisen papillektomian jälkeen samalla patogeneettisellä mekanismilla kuin papillektomian jälkeinen haimatulehdus, ja tosiasiassa on raportoitu tapauksesta, jossa on esiintynyt sappitietulehdus endoskooppisen papillektomian jälkeen . Joka tapauksessa ennaltaehkäisevää sappitiesten stenttausta toimenpiteen jälkeisen sappitietulehduksen riskin vähentämiseksi ei ole tehty laajalti, eikä sitä voida tällä hetkellä suositella yhtenäisesti, ellei ole huolta sappiteiden riittämättömästä tyhjennyksestä papillektomian jälkeen.
Komplikaatiot
Ampulliaaristen adenoomien endoskooppista poistoa pidetään ”korkean riskin” toimenpiteenä komplikaatioiden suhteen, ja sen sairastuvuus on 23 % (vaihteluväli 10-58 %) ja kuolleisuus 0,4 % (vaihteluväli 0- 7 %). Suurten tertiäärisen hoidon keskusten ja kokeneiden terapeuttisten endoskooppien raportoimat komplikaatioluvut ovat seuraavat: haimatulehdus 8-15 %, perforaatio 0-4 %, verenvuoto 2-13 %, sappitulehdus 0-2 % ja papillaarinen ahtauma 0-8 %. Tämän vuoksi olisi harkittava toimenpiteen jälkeistä sairaalahoidon tarkkailujaksoa mahdollisten välittömien tai lievästi viivästyneiden komplikaatioiden havaitsemiseksi ja hoitamiseksi, erityisesti suurten leesioiden laajamittaisen poiston ja hoidon jälkeen, potilailla, joilla on liitännäissairauksia, potilailla, joilla ei ole helppoa pääsyä lääkärinhoitoon, ja potilailla, joilla ei ole tukitoimia.
Useimmissa kirjallisuudessa raportoiduissa verenvuototapauksissa viitataan menettelyyn liittyvään verenvuotoon, ja ne on hoidettu endoskooppisesti saman toimenpiteen aikana. Näkemykset ovat yksimielisiä siitä, että näitä ei pitäisi pitää komplikaatioina. Viivästynyt verenvuoto on raportoitu noin 3 prosentissa tapauksista, ja se on yleensä myös hoidettu konservatiivisesti tai endoskooppisella uusintatoimenpiteellä. Vain muutamissa tapauksissa on raportoitu vakavaa haimatulehdusta, joka vaati pitkää sairaalahoitoa. Leikkausta tarvitaan harvoin .
Myöhäiskomplikaatioihin kuuluu haima- tai sappitiestenoosin kehittyminen; nämä komplikaatiot näyttävät olevan yleisempiä potilailla, joille ei ole asennettu papillektomian jälkeen haimatiehyen stenttejä (15.4 %) verrattuna potilaisiin, jotka saivat haimastenttejä (1,1 %) . Joidenkin kirjoittajien mukaan komplikaatioiden määrää on mahdollista vähentää rutiininomaisella sappi- ja haiman sulkijalihaksen sulkijalihaksen poistolla, haiman stentin asettamisella ennen resektiota, epinefriinin submukosaalisella injektoinnilla ja kappalemittaisella resektiolla suuremmissa leesioissa.
Endoskooppisen hoidon tulokset
Taulukossa 5 esitetään kirjallisuudessa raportoidut ampullin kasvainten endoskooppisen hoidon tulokset. On huomattava, että Catalanon ym. tutkimuksessa, onnistumisprosentti oli yhteydessä vanhempaan ikään (54,7 vs. 46,6 vuotta; P=0,08), pienempiin leesioihin (21,1 vs. 29,7 mm; P<0,0001) ja sporadisiin leesioihin (63 leesiota 72:sta vs. 20 leesiota 31:stä; P=0,02) .
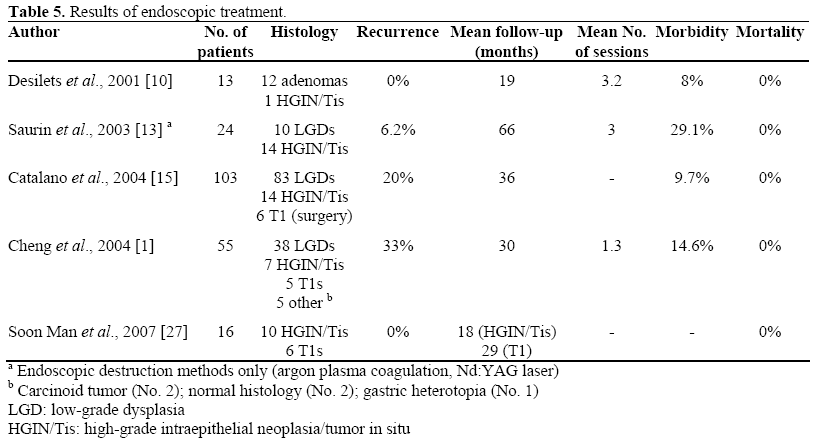
Bohnacker ym. keskittyivät tuloksissa intraduktaalisen kasvaimen kasvun olemassaoloon tai puuttumiseen; raportissaan, joka toteutettiin 106 potilaalla, joita tutkittiin 43 kuukauden mediaaniseurannan ajan, kirjoittajat havaitsivat, että endoskooppinen resektio oli parantava 83 %:lla potilaista, joilla ei ollut intraduktaalista kasvua, ja 46 %:lla potilaista, joilla oli intraduktaalista kasvua (P<0.001), ja päättelivät, että endoskooppinen ampullektomia on turvallinen ja tehokas, ja se voi olla toteuttamiskelpoinen alle 1 cm:n intraduktaalikasvaimissa.
Tutkimuksessa Cheng ym, , kuudella potilaalla (55:stä osallistuneesta potilaasta) oli intraduktaalisia kasvaimia: kahdelle tehtiin kirurginen resektio, jota pidettiin ensisijaisena hoitomuotona; neljälle potilaalle (huonoja leikkauskandidaatteja tai leikkauksesta kieltäytyneitä) tehtiin intraduktaalihoito Nd:YAG-laserilla (2 potilasta) tai endoskooppinen snare-resektio (2 potilasta). Näillä neljällä potilaalla intraduktaalinen kasvain saatiin poistettua, vaikka yhdellä laserhoitoa saaneista potilaista kasvain uusiutui keskimäärin 12 kuukauden seurannassa. Kirjoittajat ehdottavat siis, että potilailla, joita ei voida leikata, intraduktaalinen adenooma voidaan poistaa myös ottamatta huomioon Bohnackerin ilmoittamaa raja-arvoa (kasvain ulottuu alle 1 cm:n etäisyydelle sappitiehyen suuaukosta).
Kirjallisuudessa raportoitu uusiutumisprosentti vaihtelee 0-33 %:iin; altistaviin tekijöihin näyttäisi liittyvän suurempi koko ja geneettinen alttius; adjuvanttisen lämpöablaatio-menetelmän käytöllä voidaan pienentää uusiutumisprosenttia, vaikkakin siihen liittyy myös lisääntyvää sairastuvuutta . Hyvin usein uusiutuva kudos on kuitenkin kooltaan rajallinen, histologisesti hyvänlaatuinen, ilman intraduktaalista kasvua ja siten helposti endoskooppisten tekniikoiden käytettävissä.
Valvonta endoskooppisen hoidon jälkeen
Optimaalista valvontaohjelmaa ampullaarikasvaimen täydellisen poiston jälkeen ei ole standardoitu. Kirjallisuudessa raportoitujen kokemusten perusteella vaikuttaa suotavalta – kun täydellinen poisto on saavutettu – suorittaa ERCP ja ottaa biopsiat ampullaarialueen alueelta kuuden kuukauden välein kahden vuoden ajan.
Tapauksissa, joissa ei ole havaittu uusiutumista kahden vuoden jälkeen, endoskooppinen seuranta olisi suoritettava useammin potilailla, joilla on familiaalinen adenomatoottinen polyposis, kuin potilailla, joilla on sporadisia leesioita, koska pohjukaissuolia ympäröivien adenoomien esiintyvyys on suuri ja periampullaarialueen syövän riski. Tämän vuoksi potilaille, joilla on familiaalinen adenomatoottinen polypoosi, olisi tehtävä tähystys kolmen vuoden välein, kun taas muille potilaille tähystys olisi toistettava vain oireiden ilmaantuessa.
Johtopäätökset
Pohjukaissuolen ison papillan adenoomien endoskooppinen hoito on turvallinen ja hyvin siedetty vaihtoehto leikkaushoidolle. Asiantuntijoiden käsissä komplikaatiot ovat harvinaisia, eikä leikkausta yleensä tarvita. Sopivat potilaat on valittava huolellisesti, ja endoskooppinen seuranta on varmistettava. Tarvitaan pidempää seurantaa, jotta voidaan määrittää todellinen uusiutumisprosentti (kirjallisuudessa 33 %) ja endoskooppisen jälkihoidon pitkän aikavälin tulokset.
Esintressiristiriita
Kirjoittajilla ei ole mahdollisia eturistiriitoja
- Cheng CL, Sherman S, Fogel EL, McHenry L, Watkins JL, Fukushima T, et al. Endoscopic snare papillectomy for tumors of the duodenal papillae. Gastrointest Endosc 2004; 60:757-64.
- Yeo CJ, Cameron JL, Sohn TA, Lillemoe KD, Pitt HA, Talamini MA, et al. Six hundred fifty consecutive pancreaticoduodenectomies in the 1990s: pathology, complications, and outcomes. Ann Surg 1997; 226:248-60.
- Bohnacker S, Soehendra N, Maguchi H, Chung JB, Howell DA. Vaterin papillan hyvänlaatuisten kasvainten endoskooppinen resektio. Endoscopy 2006; 38:521-5.
- Standards of Practice Committee, Adler DG, Qureshi W, Davila R, Gan SI, Lichtenstein D, et al. The role of endoscopy in ampullary and duodenal adenomas. Gastrointest Endosc 2006; 64:849-54.
- Elek G, Gyôri S, Tóth B, Pap A. Histological evaluation of preoperative biopsies from ampulla vateri. Pathol Oncol Res 2003; 9:32-41.
- Seewald S, Omar S, Soehendra N. Vaterin ampullan kasvainten endoskooppinen resektio: kuinka pitkälle ylös ja kuinka syvälle voimme mennä? Gastrointest Endosc 2006; 63:783-8.
- Bohnacker S, Seitz U, Nguyen D, Thonke F, Seewald S, deWeerth A, et al. Endoscopic resection of benign tumors of the duodenal papilla without and with intraductal growth. Gastrointest Endosc 2005; 62:551- 60.
- Groves CJ, Saunders BP, Spigelman AD, Phillips RK. Pohjukaissyöpä potilailla, joilla on familiaalinen adenomatoottinen polypoosi (FAP): 10 vuoden prospektiivisen tutkimuksen tulokset. Gut 2002; 50:636-41.
- Björk J, Akerbrant H, Iselius L, Bergman A, Engwall Y, Wahlström J, et al. Periampullary adenomas and adenocarcinomas in familial adenomatous polyposis: cumulative risks and APC gene mutations. Gastroenterology 2001; 121:1246-8.
- Desilets DJ, Dy RM, Ku PM, Hanson BL, Elton E, Mattia A, Howell DA. Suuren pohjukaissuolen papillan kasvainten endoskooppinen hoito: hienostuneet tekniikat lopputuloksen parantamiseksi ja komplikaatioiden välttämiseksi. Gastrointest Endosc 2001; 54:202-8.
- Eswaran SL, Sanders M, Bernadino KP, Ansari A, Lawrence C, Stefan A, et al. Success and complications of endoscopic removal of giant duodenal and ampullary polyps: a comparative series. Gastrointest Endosc 2006; 64:925-32.
- Norton ID, Gostout CJ, Baron TH, Geller A, Petersen BT, Wiersema MJ. Suuren pohjukaissuolen papillan endoskooppisen snare-excisionin turvallisuus ja tulokset. Gastrointest Endosc 2002; 56:239-43.
- Saurin JC, Chavaillon A, Napoléon B, Descos F, Bory R, Berger F, Ponchon T. Pitkän aikavälin seuranta potilailla, joilla on hoidettu endoskooppisesti papilla vaterin sporadisia adenoomia. Endoscopy 2003; 35:402-6.
- Martin JA, Haber GB, Kortan PP, Raijman I, Abedi M, DuVall GA. Endoskooppinen snare-ampullektomia hyvänlaatuisten ampullaaristen kasvainten resektiossa. Gastrointest Endosc 1997; 45:AB139.
- Catalano MF, Linder JD, Chak A, Sivak MV Jr, Raijman I, Geenen JE, Howell DA. Pohjukaissuolen suuren papillan adenooman endoskooppinen hoito. Gastrointest Endosc 2004; 59:225-32.
- Binmoeller KF, Boaventura S, Ramsperger K, Soehendra N. Endoscopic snare excision of benign adenomas of the papilla of Vater. Gastrointest Endosc 1993; 39:127-31.
- Zádorová Z, Dvofák M, Hajer J. Endoscopic therapy of benign tumors of the papilla of Vater. Endoscopy 2001; 33:345-7.
- Tarnasky PR, Palesch YY, Cunningham JT, Mauldin PD, Cotton PB, Hawes RH. Pancreatic stenting prevents pancreatitis after biliary sphincterotomy in patients with sphincter of Oddi dysfunction. Gastroenterology 1998; 115:1518-24.
- Fazel A, Quadri A, Catalano MF, Meyerson SM, Geenen JE. Estääkö haimakanavan stentti ERCP:n jälkeisen haimatulehduksen? Prospektiivinen satunnaistettu tutkimus. Gastrointest Endosc 2003; 57:291-4.
- Harewood GC, Pochron NL, Gostout CJ. Prospektiivinen, satunnaistettu, kontrolloitu tutkimus profylaktisesta haiman stentin asettamisesta pohjukaissuolen ampullin endoskooppisen snaren poiston yhteydessä. Gastrointest Endosc 2005; 62:367-70.
- Choi JJ, Kim MH, Kim GD, Kim JK, Park JT, Oh DR, Seo WJ ym. ampullaarisen adenooman endoskooppisen limakalvoresektion aiheuttama papillaarinen stenoosi ja kolangiitti. Korean J Gastrointest Endosc 2003; 27:249- 53.
- Katsinelos P, Paroutoglou G, Kountouras J, Beltsis A, Papaziogas B, Mimidis K, et al. Turvallisuus ja pitkäaikaisseuranta ampullaaristen adenoomien endoskooppisen snare-eksektion jälkeen. Surg Endosc 2006; 20:608-13.
- Rivadeneira DE, Pochapin M, Grobmyer SR, Lieberman MD, Christos PJ, Jacobson I, Daly JM. Lineaarirakenteisen endoskooppisen ultraäänen ja spiraalisen tietokonetomografian vertailu periampullaristen maligniteettien staging-menetelmässä. Ann Surg Oncol 2003; 10:890-7.
- Rösch T, Lorenz R, Braig C, Feuerbach S, Siewert JR, Schusdziarra V, Classen M. Endoscopic ultrasound in pancreatic tumor diagnosis. Gastrointest Endosc 1991; 37:347-52.
- Sugiyama M, Hagi H, Atomi Y, Saito M. Diagnosis of portal venous invasion by pancreatobiliary carcinoma: value of endoscopic ultrasonography. Abdom Imaging 1997; 22:434-8.
- Gress FG, Hawes RH, Savides TJ, Ikenberry SO, Cummings O, Kopecky K, et al. Role of EUS in the preoperative staging of pancreatic cancer: a large single-center experience. Gastrointest Endosc 1999; 50:786-91.
- Yoon SM, Kim MH, Kim MJ, Jang SJ, Lee TY, Kwon S, ym Gastrointest Endosc 2007; 66:701-7.