Kemian oppija
Bromitrifluoridi on myrkyllinen interhalogeeniyhdiste. Se tunnetaan käyttötarkoituksistaan voimakkaana fluorausaineena.
- Bromitrifluoridi Tunnistaminen
- Kemiallinen kaava bromitrifluoridille
- Bromitrifluoridin valmistus
- Bromitrifluoridi Koostumus
- Bromitrifluoridin ominaisuudet
- Eritys
- Haju
- Hygroskooppisuus
- Molaarinen massa
- Monoisotooppinen massa
- Tiheys
- Sulamispiste
- Kiehumispiste
- Johtokyky
- Korrosiivisuus
- Ominaispaino
- Dipolimomentti
- Liukoisuus
- Bromitrifluoridin rakenne
- Bromitrifluoridin reaktiot
- Bromitrifluoridi Käyttökohteet
- Bromitrifluoridin käyttöturvallisuustiedote
- Terveysvaarat
- Ensiaputoimenpiteet
- Reaktiivisuusprofiili
- Palontorjuntatoimenpiteet
- Toimenpiteet vahingossa tapahtuvan vapautumisen varalta
- Bromitrifluoridin käsittely
- Bromitrifluoridin varastointi
- Henkilönsuojaimet
Bromitrifluoridi Tunnistaminen
CAS-numero: 7787-71-5
UN-numero: UN1746
PubChem Compound ID: 24594
ChemSpider Reference Number: 20474213
MDL number: MFCD00042533
EC-numero: 232-132-1
RTECS-numero: ED2275000
InChI-tunniste: InChI=1S/BrF3/c2-1(3)4
InChI Key: InChIKey=FQFKTKUFHWNTBN-UHFFFAOYSA-N
Kemiallinen kaava bromitrifluoridille
Tämän interhalogeeniyhdisteen kemiallinen kaava on BrF3.
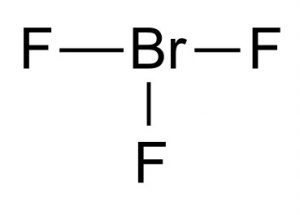
Kuva 1 – Bromitrifluoridi
Bromitrifluoridin valmistus
Vuonna 1906 Paul Lebeau syntetisoi tämän yhdisteen ensimmäisen kerran reagoimalla bromin ja fluorin kanssa 20 °C:n lämpötilassa. Reaktio esitetään seuraavalla yhtälöllä:
Br2 + 3F2 → 2BrF3
Toinen tapa valmistaa bromitrifluoridia on pelkistää ja hapettaa samanaikaisesti bromimonofluoridia. Tässä reaktiossa syntyy bromitrifluoridia ja bromia.
3BrF → BrF3 + Br2
Bromitrifluoridi Koostumus
Bromitrifluoridi koostuu 58,367 % bromista ja 41.632 % fluoria.
Bromitrifluoridin ominaisuudet
Aineen fysikaalisia ja kemiallisia ominaisuuksia käsitellään seuraavassa:
Eritys
Se on oljenvärinen neste.
Haju
Kemikaalilla on pistävä haju.
Hygroskooppisuus
Se on hygroskooppinen neste.
Molaarinen massa
Bromitrifluoridin molaarinen massa on 136.90 g/mol.
Monoisotooppinen massa
Tämän aineen monoisotooppinen massa on 135,913547 u (yhtenäiset atomimassayksiköt).
Tiheys
Aineen tiheys on 2,803 g/cm3.
Sulamispiste
Bromitrifluoridin sulamispiste on 8,77 °C.
Kiehumispiste
Aineen kiehumispiste on 125,72°C.
Johtokyky
Autoionisaation vuoksi neste johtaa hyvin sähköä.
Korrosiivisuus
Se on syövyttävä neste.
Ominaispaino
Bromitrifluoridin ominaispaino on 2,81 lämpötilassa 68,0°F.
Dipolimomentti
Tämän aineen molekyylin dipolimomentti on 1,19 Debye.
Liukoisuus
Bromitrifluoridi liukenee rikkihappoon. Se hajoaa ja räjähtää joutuessaan kosketuksiin orgaanisten yhdisteiden ja veden kanssa. Reaktiot vetyä sisältävien yhdisteiden kanssa voivat aiheuttaa voimakkaita reaktioita. Monet ioniset fluoridit liukenevat helposti bromitrifluoridiin ja muodostavat solvobaaseja.
KF + BrF3 → KBrF4
Yllämainittujen ominaisuuksien lisäksi bromitrifluoridi on myös voimakas fluorausaine.
Bromitrifluoridin rakenne
Bromitrifluoridin Lewisin rakenne osoittaa, että sillä on T-muotoinen molekyylirakenne. Molekyylinmuodostuksen VSEPR-teorian mukaan keskeiseen bromiiniin liittyy kaksi elektroniparia. Bromin keskuksen etäisyys ekvatoriaalisesta fluorista on 1,72 Å ja kustakin aksiaalisesta fluorista 1,81 Å. Ekvatoriaalisen fluorin ja aksiaalisen fluorin välinen kulma on 86,2°. Kulma pysyy hieman alle 90°, koska Br-F-sidosten repulsiovoima on pienempi kuin elektroniparien voima.
Bromitrifluoridin reaktiot
Bromitrifluoridi reagoidessaan metallioksidien kanssa antaa happea. Bromitrifluoridin reagoidessa piidioksidin kanssa syntyy kaasumaista piitetrafluoridia ja bromia.
Bromitrifluoridin ja titaani(IV)oksidin välisessä reaktiossa syntyy titaani(IV)fluoridia ja bromia.
Bromitrifluoridi Käyttökohteet
Bromitrifluoridi on vahvasti ionisoiva epäorgaaninen liuotin ja fluorausaine. Sitä käytetään myös uraaniheksafluoridin (UF6) valmistukseen ydinpolttoaineen käsittelyn ja jälleenkäsittelyn yhteydessä.
Bromitrifluoridin käyttöturvallisuustiedote
Terveysvaarat
Bromitrifluoridille altistuva ihminen voi kärsiä seuraavista terveyshaitoista:
ihokosketus: Ihokosketus tämän kemikaalin kanssa voi aiheuttaa polttavia ja ärsyttäviä tuntemuksia.
Silmäkosketus: Jos silmät joutuvat kosketuksiin kemikaalihöyryjen tai itse kemikaalin kanssa, se voi johtaa vakavaan silmien polttamiseen, haavaumiin ja jopa sokeutumiseen.
Nieleminen: Nieleminen johtaa vakavaan limakalvojen palamiseen.
Hengittäminen: Hengittäminen voi johtaa vakavaan ylähengitysteiden ärsytykseen.
Ensiaputoimenpiteet
Silmät: Silmät on pestävä huolellisesti runsaalla vedellä vähintään 15 minuutin ajan. Lääkärin puoleen on käännyttävä välittömästi.
Iho: Jos iho joutuu kosketuksiin kemikaalin kanssa, tartunta-alueet on pestävä hyvin vedellä ja saippualla vähintään 15 minuutin ajan. Välitön lääkärinhoito on tarpeen. Saastunut vaatetus on riisuttava nopeasti. Vaatteet on puhdistettava ja kuivattava huolellisesti ennen uudelleenkäyttöä. Saastuneet kengät on hävitettävä.
Nieleminen: Vahingossa tapahtuneen nielemisen yhteydessä uhrin on juotava runsaasti vettä. Oksentamisen aiheuttamista ei suositella.
Hengittäminen: Jos haittavaikutuksia ilmenee, uhri on vietävä saastumattomalle alueelle. Keinohengitystä on käytettävä, jos uhri ei hengitä. Jos hengitys ja hengitys on edelleen vaikeaa, on annettava happea. Uhrin turvallisuuden varmistamiseksi tarvitaan lisää lääketieteellistä apua.
Reaktiivisuusprofiili
Bromitrifluoridi on erittäin reaktiivinen hapettava aine. Se reagoi voimakkaasti joutuessaan kosketuksiin veden kanssa. Se voi nopeuttaa palavan aineen palamista. Kun se joutuu kosketuksiin vetyä sisältävien aineiden, kuten etikkahapon, ammoniakin ja metaanin kanssa, se voi aiheuttaa räjähdyksen ja tulipalon. Se reagoi myös rajusti happojen, halogeenien, metallihalogenidien, metallien ja metallioksidien kanssa huoneenlämmössä. Erityisesti se aiheuttaa vaarallisia reaktioita typpihapon, rikkihapon, jodin ja seleenin kanssa.
Palontorjuntatoimenpiteet
Bromitrifluoridi on hapettava aine, joten se voi syttyä tai räjähtää joutuessaan kosketuksiin palavien aineiden kanssa.
Suurten tulipalojen sattuessa alue on eristettävä ja tulvattava vedellä turvalliselta etäisyydeltä. Jos bromitrifluoridia varastoivat säiliöt ovat lähellä tulipaloa, ne olisi poistettava, jos se voidaan tehdä turvallisesti. Säiliöitä on jäähdytettävä virtaavalla vedellä vielä kauan sen jälkeen, kun tulipalo on sammutettu.
Palonsammutusaineet: Tulipaloa sammutettaessa on käytettävä asianmukaisia sammutusaineita. Veden, kuivakemikaalin tai soodan käyttöä suositellaan palon sammuttamiseen.
Toimenpiteet vahingossa tapahtuvan vapautumisen varalta
Palavat materiaalit on eristettävä ja kaikkea yhteyttä niiden kanssa on vältettävä. Vuotaneeseen materiaaliin ei saa koskea. Kemikaalivuoto on pysäytettävä, jos se on mahdollista tehdä ilman henkilöriskiä. Kemikaalihöyryjen esiintymistä on vähennettävä vesisuihkulla. On huolehdittava siitä, ettei vettä pääse kemikaalisäiliöiden sisälle. Jos kemikaaleja on vuotanut suuria määriä, ne on eristettävä karanteeniin, jotta ne voidaan hävittää myöhemmin. Alue on tuuletettava asianmukaisesti.
Bromitrifluoridin käsittely
Tämän aineen käsittelyyn sovelletaan U.S. OSHA 29 CFR 1910.119:n mukaisia käsittelymääräyksiä.
Bromitrifluoridin varastointi
Kemikaali on varastoitava ja käsiteltävä voimassa olevien NFPA 430 Code for the storage of Liquid and Solid Oxidizing Materials standardien ja määräysten mukaisesti. Kemikaalisäiliöt on suojattava kaikenlaisilta fyysisiltä vaurioilta. Ne on myös pidettävä erillään yhteensopimattomista aineista.
Henkilönsuojaimet
Käsiteltäessä tätä kemikaalia on suojauduttava asianmukaisesti. On käytettävä asianmukaisia suojavarusteita. Niihin tulisi mieluiten kuulua:
- MSHA/NIOSH (hyväksytty tai vastaava) suljettu hengityslaite, jossa on paineistettu happinaamari, vaaditaan asianmukaisen hengityksen varmistamiseksi.
- OSHA:n hyväksymät suojalasit tai suojalasit vaaditaan silmien suojaamiseksi.
- Ihon suojaamiseksi kemikaalikontaktista aiheutuvilta haitallisilta infektioilta on käytettävä suojavaatetusta ja suojakäsineitä.
Edellä mainittujen suojavarusteiden lisäksi alueen on myös oltava hyvin tuuletettu. Ilmanvaihtomekanismin tulisi olla räjähdyssuojattu, jos kemikaalissa on räjähtäviä pitoisuuksia. Lisäksi olisi oltava paikallinen poistojärjestelmä.