Biologia para Majors I
Classificar diferentes tipos de ligações atómicas
Quando os átomos se unem, eles criam elementos. Os diferentes tipos de ligações (iónica e covalente, polar e não polar) têm um impacto sobre os elementos que criam. A compreensão dos tipos de ligações que criam coisas pode ajudar-nos a compreender essas mesmas coisas.
Objectivos de aprendizagem
- Descrever as características das ligações iónicas e identificar os iões comuns
- Descrever as características das ligações covalentes e diferenciar entre polares e não-polares.ligações polares
- Modelo uma ligação de Hidrogénio e identificar as suas qualidades únicas
Ligações isónicas
Alguns átomos são mais estáveis quando ganham ou perdem um electrão (ou possivelmente dois) e formam iões. Isto preenche a sua casca de electrões mais externa e torna-os energeticamente mais estáveis. Como o número de elétrons não é igual ao número de prótons, cada íon tem uma carga líquida. Os catiões são iões positivos que são formados pela perda de electrões. Os íons negativos são formados por ganhar elétrons e são chamados de ânions. Os ânions são designados pelo seu nome elementar sendo alterados para terminar em “-ide”: o ânion do cloro é chamado cloreto, e o ânion do enxofre é chamado sulfeto, por exemplo.
Este movimento de elétrons de um elemento para outro é referido como transferência de elétrons. Como ilustra a Figura 1, o sódio (Na) tem apenas um elétron no seu invólucro externo de elétrons. É necessária menos energia para o sódio doar esse elétron do que para aceitar mais sete elétrons para preencher o invólucro externo. Se o sódio perder um elétron, ele agora tem 11 prótons, 11 nêutrons e apenas 10 elétrons, deixando-o com uma carga total de +1. É agora referido como um íon de sódio. O cloro (Cl) no seu estado de menor energia (chamado estado de terra) tem sete elétrons em seu invólucro externo. Mais uma vez, é mais eficiente energeticamente para o cloro ganhar um electrão do que perder sete. Portanto, ele tende a ganhar um elétron para criar um íon com 17 prótons, 17 nêutrons e 18 elétrons, dando-lhe uma carga líquida negativa (-1). É agora referido como um íon cloreto. Neste exemplo, o sódio doará seu único elétron para esvaziar sua casca, e o cloro aceitará esse elétron para encher sua casca. Ambos os iões satisfazem agora a regra do octeto e têm conchas mais exteriores completas. Como o número de elétrons não é mais igual ao número de prótons, cada um deles é agora um íon e tem uma carga +1 (cátion de sódio) ou -1 (ânion de cloreto). Note que essas transações normalmente só podem ocorrer simultaneamente: para que um átomo de sódio perca um elétron, ele deve estar na presença de um recipiente adequado como um átomo de cloro.
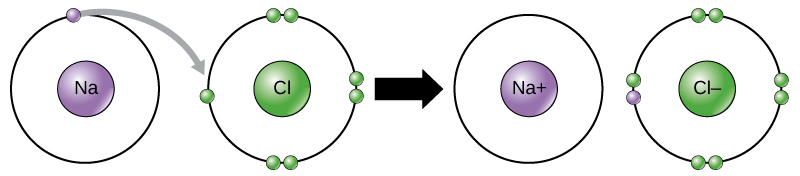
Figure 1. Na formação de um composto iônico, os metais perdem elétrons e os não-metálicos ganham elétrons para alcançar um octeto. Ligações iônicas são formadas entre íons com cargas opostas. Por exemplo, íons de sódio com carga positiva e íons de cloreto com carga negativa se unem para fazer cristais de cloreto de sódio, ou sal de mesa, criando uma molécula cristalina com carga líquida zero.
Ligações iônicas são formadas entre íons com cargas opostas. Por exemplo, íons de sódio com carga positiva e íons de cloreto com carga negativa se unem para formar cristais de cloreto de sódio, ou sal de mesa, criando uma molécula cristalina com carga líquida zero.
Certos sais são referidos na fisiologia como eletrólitos (incluindo sódio, potássio e cálcio), íons necessários para a condução do impulso nervoso, contrações musculares e equilíbrio da água. Muitas bebidas esportivas e suplementos dietéticos fornecem esses íons para substituir aqueles perdidos do corpo através do suor durante o exercício.
Video Review
Este vídeo mostra como os compostos iônicos se formam a partir de ânions e cátions.
Ligações covalentes
Uma outra forma de satisfazer a regra do octeto é através da partilha de elétrons entre os átomos para formar ligações covalentes. Estas ligações são muito mais comuns que as ligações iónicas nas moléculas dos organismos vivos. Ligações covalentes são normalmente encontradas em moléculas orgânicas baseadas em carbono, tais como o nosso ADN e proteínas. As ligações covalentes também são encontradas em moléculas inorgânicas como H2O, CO2 e O2. Um, dois ou três pares de elétrons podem ser compartilhados, fazendo ligações simples, duplas e triplas, respectivamente. Quanto mais covalentes as ligações entre dois átomos, mais forte é a sua ligação. Assim, as ligações triplas são as mais fortes.
A força dos diferentes níveis de ligação covalente é uma das principais razões pelas quais os organismos vivos têm dificuldade em adquirir nitrogênio para uso na construção de suas moléculas, ainda que o nitrogênio molecular, N2, seja o gás mais abundante na atmosfera. O nitrogênio molecular consiste em dois átomos de nitrogênio triplamente ligados um ao outro e, como acontece com todas as moléculas, a partilha destes três pares de elétrons entre os dois átomos de nitrogênio permite o preenchimento de suas conchas eletrônicas externas, tornando a molécula mais estável do que os átomos de nitrogênio individuais. Esta forte ligação tripla torna difícil para os sistemas vivos quebrar este nitrogénio para o utilizar como constituintes de proteínas e DNA.
A formação de moléculas de água fornece um exemplo de ligação covalente. Os átomos de hidrogénio e oxigénio que se combinam para formar moléculas de água são ligados entre si por ligações covalentes. O electrão do hidrogénio divide o seu tempo entre a casca exterior incompleta dos átomos de hidrogénio e a casca exterior incompleta dos átomos de oxigénio. Para preencher completamente a casca exterior do oxigénio, que tem seis electrões na sua casca exterior mas que seria mais estável com oito, são necessários dois electrões (um de cada átomo de hidrogénio): daí a conhecida fórmula H2O. Os elétrons são compartilhados entre os dois elementos para preencher a casca externa de cada um, tornando os dois elementos mais estáveis.
Veja este pequeno vídeo para ver uma animação de ligação iônica e covalente.
Ligações Covalentes Polares
Existem dois tipos de ligações covalentes: polares e não polares. Em uma ligação covalente polar, mostrada na Figura 2, os elétrons são desigualmente compartilhados pelos átomos e são atraídos mais para um núcleo do que para o outro. Devido à distribuição desigual dos elétrons entre os átomos de diferentes elementos, desenvolve-se uma carga ligeiramente positiva (δ+) ou ligeiramente negativa (δ-). Esta carga parcial é uma propriedade importante da água e é responsável por muitas das suas características.
A água é uma molécula polar, com os átomos de hidrogênio adquirindo uma carga parcialmente positiva e o oxigênio uma carga parcialmente negativa. Isto ocorre porque o núcleo do átomo de oxigênio é mais atraente para os elétrons dos átomos de hidrogênio do que o núcleo de hidrogênio é para os elétrons do oxigênio. Assim, o oxigênio tem uma eletronegatividade maior que o hidrogênio e os elétrons compartilhados passam mais tempo nas proximidades do núcleo do oxigênio do que perto do núcleo dos átomos de hidrogênio, dando aos átomos de oxigênio e hidrogênio cargas ligeiramente negativas e positivas, respectivamente. Outra forma de afirmar isto é que a probabilidade de encontrar um electrão partilhado perto de um núcleo de oxigénio é mais provável do que encontrá-lo perto de um núcleo de hidrogénio. De qualquer forma, a relativa eletronegatividade do átomo contribui para o desenvolvimento de cargas parciais sempre que um elemento é significativamente mais electronegativo que o outro e as cargas geradas por estas ligações polares podem então ser utilizadas para a formação de ligações de hidrogênio com base na atração de cargas parciais opostas. (As ligações de hidrogênio, que são discutidas em detalhe abaixo, são ligações fracas entre átomos de hidrogênio ligeiramente carregados positivamente e átomos ligeiramente carregados negativamente em outras moléculas). Uma vez que as macromoléculas têm frequentemente átomos dentro delas que diferem em electronegatividade, as ligações polares estão frequentemente presentes em moléculas orgânicas.
Nonpolar Ligações Covalentes

Figure 2. Se uma molécula é polar ou não-polar depende tanto do tipo de ligação como da forma molecular. Tanto a água como o dióxido de carbono têm ligações polares covalentes, mas o dióxido de carbono é linear, portanto as cargas parciais na molécula cancelam-se mutuamente.
As ligações covalentes não polares formam-se entre dois átomos do mesmo elemento ou entre elementos diferentes que partilham electrões igualmente. Por exemplo, oxigênio molecular (O2) é não-polar porque os elétrons serão distribuídos igualmente entre os dois átomos de oxigênio.
Outro exemplo de uma ligação covalente não-polar é o metano (CH4), também mostrado na Figura 2. O carbono tem quatro elétrons em sua casca mais externa e precisa de mais quatro para preenchê-lo. Ele obtém estes quatro de quatro átomos de hidrogênio, cada átomo fornecendo um, fazendo um invólucro externo estável de oito elétrons. Carbono e hidrogênio não têm a mesma eletronegatividade, mas são semelhantes; assim, as ligações não-polares se formam. Cada átomo de hidrogênio precisa de um elétron para sua casca externa, que é preenchida quando contém dois elétrons. Estes elementos partilham os electrões igualmente entre os carbonos e os átomos de hidrogénio, criando uma molécula não polar covalente.
Veja este vídeo para outra explicação das ligações covalentes e como se formam:
Ligações de hidrogénio
Ligações iónicas e covalentes entre elementos requerem energia para se romperem. As ligações icónicas não são tão fortes como as covalentes, o que determina o seu comportamento nos sistemas biológicos. Contudo, nem todas as ligações são ligações iónicas ou covalentes. Ligações mais fracas também se podem formar entre as moléculas. Duas ligações fracas que ocorrem frequentemente são as ligações de hidrogénio e as interacções van der Waals. Sem estes dois tipos de ligações, a vida tal como a conhecemos não existiria. As ligações de hidrogênio fornecem muitas das propriedades críticas e sustentáveis da água e também estabilizam as estruturas das proteínas e do DNA, o bloco de construção das células.
Quando as ligações polares covalentes contêm hidrogênio, o hidrogênio nessa ligação tem uma carga ligeiramente positiva porque o elétron do hidrogênio é puxado mais fortemente em direção ao outro elemento e afastado do hidrogênio. Como o hidrogênio é ligeiramente positivo, ele será atraído por cargas negativas vizinhas. Quando isso acontece, ocorre uma fraca interação entre o δ+ do hidrogênio de uma molécula e o δ- carga sobre os átomos mais eletronegativos de outra molécula, geralmente oxigênio ou nitrogênio, ou dentro da mesma molécula. Essa interação é chamada de ligação de hidrogênio. Este tipo de ligação é comum e ocorre regularmente entre moléculas de água. As ligações individuais de hidrogênio são fracas e facilmente quebráveis; no entanto, elas ocorrem em grande número na água e em polímeros orgânicos, criando uma grande força em combinação. As ligações de hidrogênio também são responsáveis por zipar juntas a dupla hélice de DNA.
Check Your Understanding
Responda a(s) pergunta(s) abaixo para ver o quão bem você entende os tópicos abordados na seção anterior. Este pequeno questionário não conta para a sua nota na classe, e você pode repeti-lo um número ilimitado de vezes.
Utilize este questionário para verificar a sua compreensão e decidir se (1) estudar mais a seção anterior ou (2) passar para a próxima seção.