Chemistry Learner
Bromtrifluorid är en giftig interhalogenförening. Den är känd för sina användningsområden som ett starkt fluoreringsmedel.
- Bromtrifluorid Identifiering
- Kemisk formel för bromtrifluorid
- Produktion av bromtrifluorid
- Bromtrifluorid Sammansättning
- Bromtrifluoridens egenskaper
- Utseende
- Lukt
- Hygroskopi
- Molarmassa
- Monoisotopisk massa
- Densitet
- Smältpunkt
- Kokpunkt
- Ledningsförmåga
- Korrosivitet
- Specifik vikt
- Dipolmoment
- Löslighet
- Bromtrifluoridens struktur
- Bromtrifluorid Reaktioner
- Bromtrifluorid Användning
- Bromtrifluorid MSDS
- Hälsorisker
- Första hjälpen-åtgärder
- Reaktivitetsprofil
- Brandbekämpningsåtgärder
- Mått vid oavsiktligt utsläpp
- Hantering av bromintrifluorid
- Lagring av bromintrifluorid
- Personligt skydd
Bromtrifluorid Identifiering
CAS-nummer: 7787-71-5
UN-nummer: UN1746
PubChem Compound ID: 24594
ChemSpider Reference Number: 20474213
MDL-nummer: MFCD00042533
EC-nummer: 232-132-1
RTECS-nummer: 232-132-1
ED2275000
InChI Identifier: ED2275000
InChI Identifier: InChI=1S/BrF3/c2-1(3)4
InChI Key: InChIKey=FQFKTKUFHWNTBN-UHFFFAOYSA-N
Kemisk formel för bromtrifluorid
Den kemiska formeln för denna interhalogenförening är BrF3.
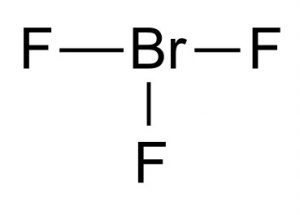
Bild 1 – Bromtrifluorid
Produktion av bromtrifluorid
Året 1906 syntetiserade Paul Lebeau för första gången denna förening genom att reagera brom med fluor vid en temperatur på 20°C. Reaktionen representeras av följande ekvation:
Br2 + 3F2 → 2BrF3
Ett annat sätt att framställa bromtrifluorid är att samtidigt reducera och oxidera brommonofluorid. Denna reaktion ger bromtrifluorid och brom.
3BrF → BrF3 + Br2
Bromtrifluorid Sammansättning
Bromtrifluorid består av 58,367 % brom och 41.632% fluor.
Bromtrifluoridens egenskaper
De fysikaliska och kemiska egenskaperna hos detta ämne diskuteras nedan:
Utseende
Det är en halmfärgad vätska.
Lukt
Kemikalien har en stickande lukt.
Hygroskopi
Det är en hygroskopisk vätska.
Molarmassa
Molarmassan för bromtrifluorid är 136.90 g/mol.
Monoisotopisk massa
Den monoisotopiska massan för detta ämne är 135,913547 u (unified atomic mass units).
Densitet
Substansens densitet är 2,803 g/cm3.
Smältpunkt
Smältpunkten för bromtrifluorid är 8,77 °C.
Kokpunkt
Kokpunkten för detta ämne är 125,72°C.
Ledningsförmåga
På grund av autojonisering är vätskan en god ledare för elektricitet.
Korrosivitet
Det är en korrosiv vätska.
Specifik vikt
Den specifika vikten för bromtrifluorid är 2,81 vid en temperatur på 68,0°F.
Dipolmoment
Det molekylära dipolmomentet för detta ämne är 1,19 Debye.
Löslighet
Bromtrifluorid är lösligt i svavelsyra. Det sönderfaller och exploderar när det kommer i kontakt med organiska föreningar och vatten. Reaktioner med vätehaltiga föreningar kan orsaka våldsamma reaktioner. Många joniska fluorider löser sig lätt i bromtrifluorid och bildar solvobaser.
KF + BrF3 → KBrF4
Avse de ovan nämnda egenskaperna är bromtrifluorid också ett kraftfullt fluoriseringsmedel.
Bromtrifluoridens struktur
Lewisstrukturen för bromtrifluorid visar att den har en T-formad molekylstruktur. Enligt VSEPR-teorin för molekylbildning är det centrala bromet förbundet med två elektronpar. Avståndet mellan det centrala bromet och det ekvatoriella fluoret är 1,72 Å och till vart och ett av de axiella fluorerna är 1,81 Å. Vinkeln mellan det ekvatoriella fluoret och ett axialt fluor är 86,2°. Vinkeln hålls något mindre än 90° eftersom repulsionskraften från Br-F-bindningarna är lägre än kraften från elektronparen.
Bromtrifluorid Reaktioner
Bromtrifluorid ger vid reaktion med metalloxider syre. När bromtrifluorid reagerar med kiseldioxid bildas gasformig kiseltetrafluorid och brom.
I en reaktion mellan bromtrifluorid och titan(IV)oxid bildas titan(IV)fluorid och brom.
Bromtrifluorid Användning
Bromtrifluorid är ett starkt joniserande oorganiskt lösningsmedel och ett fluoreringsmedel. Det används också för tillverkning av uranhexafluorid (UF6) vid bearbetning och upparbetning av kärnbränsle.
Bromtrifluorid MSDS
Hälsorisker
En människa som utsätts för bromtrifluorid kan drabbas av följande hälsoproblem:
Hudkontakt: Hudkontakt med denna kemikalie kan leda till brännande och irriterande känslor.
Ögonkontakt: Om ögonen kommer i kontakt med kemikaliens ångor eller själva kemikalien kan det leda till svår sveda i ögonen, sår och till och med blindhet.
Ingestion: Om ögonen kommer i kontakt med kemikaliens ångor eller själva kemikalien kan det leda till svår sveda i ögonen, sår och till och med blindhet: Intag leder till allvarlig bränning av slemhinnorna.
Inandning: Inandning kan leda till allvarlig irritation av de övre luftvägarna.
Första hjälpen-åtgärder
Ögon: Ögonen måste tvättas noggrant med mycket vatten i minst 15 minuter. Läkare måste omedelbart konsulteras.
Hud: Om huden kommer i kontakt med kemikalien ska de infekterade områdena tvättas väl med vatten och tvål i minst 15 minuter. Omedelbar läkarvård krävs. De kontaminerade kläderna måste avlägsnas snabbt. Kläderna ska rengöras noggrant och torkas innan de återanvänds. De kontaminerade skorna bör förstöras.
Ingestion: Vid oavsiktligt intag bör offret dricka rikligt med vatten. Framkallande av kräkningar rekommenderas inte.
Inhalation: Vid eventuella biverkningar bör offret föras till ett okontaminerat område. Artificiell andning måste tillämpas om offret inte andas. Om det fortfarande är svårt att andas och andas bör syrgas administreras. Ytterligare medicinsk hjälp krävs för att garantera offrets säkerhet.
Reaktivitetsprofil
Bromtrifluorid är ett mycket reaktivt oxidationsmedel. Det reagerar våldsamt när det kommer i kontakt med vatten. Det kan påskynda förbränningen av ett brännbart ämne. När det kommer i kontakt med vätehaltiga ämnen som ättiksyra, ammoniak och metan kan det orsaka explosion och brand. Den reagerar också våldsamt med syror, halogener, metallhalogenider, metaller och metalloxider vid rumstemperatur. Det orsakar särskilt farliga reaktioner med salpetersyra, svavelsyra, jod och selen.
Brandbekämpningsåtgärder
Bromtrifluorid är ett oxidationsmedel och kan därför antändas eller explodera när det kommer i kontakt med brännbara ämnen.
Vid större bränder ska området isoleras och översvämmas med vatten från ett säkert avstånd. Om behållare som lagrar bromtrifluorid befinner sig i närheten av eld bör de avlägsnas om det kan göras på ett säkert sätt. Behållarna bör kylas med rinnande vatten även långt efter det att branden har släckts.
Brandsläckningsmedier: Lämpliga brandsläckningsmedier måste användas vid släckning av branden. Användning av vatten, torr kemikalie eller soda rekommenderas för att släcka brand.
Mått vid oavsiktligt utsläpp
De brännbara materialen ska isoleras och all förbindelse med dem ska undvikas. Det utspillda materialet bör inte beröras. Kemiskt läckage bör stoppas om det är möjligt att göra det utan personlig risk. Förekomsten av kemiska ångor bör minskas med vattenspray. Man bör se till att det inte kommer in vatten i kemikaliebehållarna. Vid stora spill bör kemikalierna sättas i karantän för att senare bortskaffas. Området bör ventileras ordentligt.
Hantering av bromintrifluorid
Hanteringen av detta material omfattas av hanteringsbestämmelser enligt U.S. OSHA 29 CFR 1910.119.
Lagring av bromintrifluorid
Kemikalien bör lagras och hanteras i enlighet med gällande standarder och bestämmelser i NFPA 430 Code for the storage of Liquid and Solid Oxidizing Materials. Kemikaliebehållarna ska skyddas från alla typer av fysiska skador. De bör också hållas borta från inkompatibla ämnen.
Personligt skydd
Vid hantering av denna kemikalie måste adekvat skydd tas. Korrekt skyddsutrustning bör användas. Dessa bör helst omfatta:
- MSHA/NIOSH (godkänd eller likvärdig) självförsörjande andningsapparat med tryckkrävande syrgasmasker krävs för korrekt andning.
- OSHA-godkända skyddsglasögon eller skyddsglasögon krävs för att skydda ögonen.
- För att skydda huden mot skadliga infektioner till följd av kemisk kontakt ska skyddskläder och handskar användas.
Förutom ovan nämnda skyddsutrustning ska området också vara väl ventilerat. Ventilationsmekanismen bör vara motståndskraftig mot explosioner om explosiva koncentrationer av kemikalien förekommer. Ett lokalt utsugningssystem bör också finnas.