Salsola soda
Den aska som erhålls vid förbränning av S. soda kan raffineras till en produkt som kallas soda, som är ett av de alkaliska material som är nödvändiga för att tillverka sodakalkglas, tvål och många andra produkter. Den huvudsakliga aktiva beståndsdelen är natriumkarbonat, med vilket termen ”soda” nu nästan är synonymt. Den bearbetade askan av S. soda innehåller så mycket som 30 % natriumkarbonat.
En hög koncentration av natriumkarbonat i askan av S. soda uppstår om växten odlas i starkt salthaltiga jordar (dvs. i jordar med en hög koncentration av natriumklorid), så att växtens vävnader innehåller en ganska hög koncentration av natriumjoner. S. soda kan bevattnas med havsvatten, som innehåller cirka 40 g/l löst natriumklorid och andra salter. När dessa natriumrika växter förbränns reagerar förmodligen den koldioxid som bildas med detta natrium och bildar natriumkarbonat.
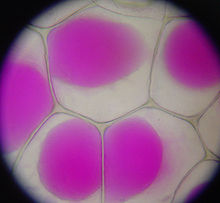
Det är förvånande att hitta en högre koncentration av natrium än av kalium i växtvävnader; det förstnämnda grundämnet är vanligtvis giftigt och det sistnämnda grundämnet är essentiellt för växternas ämnesomsättningsprocesser. Därför är de flesta växter, och särskilt de flesta kulturväxter, ”glykofyter” och lider skada när de planteras i salthaltiga jordar. S. soda, och de andra växter som odlades för soda, är ”halofyter” som tolererar mycket saltare jordar än vad glykofyter gör, och som kan trivas med mycket större tätheter av natrium i sina vävnader än vad glykofyter kan göra.
De biokemiska processerna i cellerna hos halofyter är typiskt sett lika känsliga för natrium som processerna i glykofyter. Natriumjoner från en växts jord eller bevattningsvatten är giftiga främst därför att de stör biokemiska processer i en växts celler som kräver kalium, som är ett kemiskt likartat alkalimetallelement. Cellen hos en halofyt som S. soda har en molekylär transportmekanism som binder natriumjoner till en avdelning i växtcellen som kallas ”vacuole”. Vakuolen i en växtcell kan uppta 80 % av cellens volym; det mesta av natriumet i en halofytväxtcell kan binds i vakuolen och lämnar resten av cellen med ett tolerabelt förhållande mellan natrium- och kaliumjoner.
Förutom S. soda har soda också framställts av askan från S. kali (en annan salttrådsväxt), från glasörtsplantor och från tång, en typ av sjögräs. Natriumkarbonatet, som är vattenlösligt, ”lixivieras” från askan (extraheras med vatten), och den resulterande lösningen kokas torr för att erhålla den färdiga sodaprodukten. En mycket liknande process används för att få fram kaliumkarbonat (huvudsakligen kaliumkarbonat) från askan från lövträd. Eftersom halofyter också måste ha kaliumjoner i sina vävnader innehåller även den bästa soda som utvinns ur dem också en del kaliumkarbonat (kaliumkarbonat), vilket var känt redan på 1800-talet.
Plantor var en mycket viktig källa till soda fram till början av 1800-talet. På 1700-talet hade Spanien en enorm industri som producerade barilla (en typ av växtbaserad soda) från saltörtsplantor. På samma sätt hade Skottland på 1700-talet en stor industri som producerade soda från tång. Denna industri var så lukrativ att den ledde till överbefolkning på de västra öarna i Skottland, och enligt en uppskattning var 100 000 personer sysselsatta med ”kelping” under sommarmånaderna. Kommersialiseringen av Leblanc-processen för att syntetisera natriumkarbonat (från salt, kalksten och svavelsyra) satte stopp för odlingen av natriumkarbonat under första hälften av 1800-talet.

