JOP. Journal of the Pancreas
Ampulární adenomy
Nádory Vaterovy papily jsou vzácné, v pitevních studiích se uvádí prevalence 0,04 % ± 0,12 %. Mohou se vyskytovat jako sporadické léze nebo u pacientů s familiární adenomatózní polypózou. Histologicky byla dokumentována maligní transformace benigních adenomů v karcinomy. Uváděná frekvence malignity u adenomu papily se pohybuje od 26 do 65 %. Adenomatózní reziduální ložiska, stejně jako oblasti se střední až těžkou dysplazií, byla rovněž nalezena až v 90 % resekčních vzorků karcinomu velké papily. Na základě těchto pozorování se předpokládá, že adenomy velké nebo malé papily vykazují stejnou sekvenci adenomu a karcinomu jako adenomy tlustého střeva .
Z těchto důvodů je úplné odstranění těchto lézí povinné, ale léčba volby zůstává kontroverzní.
Chirurgická léčba představuje tradiční možnost, včetně pankreatikoduodenektomie, která má peroperační mortalitu v rozmezí 2-9 % a velmi významnou míru pooperačních komplikací (ve velké sérii až 41 %), a duodenotomie s lokální excizí; ta je jistě méně invazivní, ale je spojena s lokální recidivou.
Pro nízkou morbiditu a mortalitu získává endoskopická léčba stále větší konsenzus jako léčba první volby, i když obtížná anatomická lokalizace těchto lézí činí resekci mnohem složitějším výkonem ve srovnání s polypektomií v tlustém střevě ; navíc následná operace u operabilních pacientů není vyloučena předchozí endoskopickou resekcí .
Předoperační hodnocení:
Pouze na základě endoskopického vzhledu nelze vždy odlišit ampulární adenomy od ampulárních karcinomů nebo neadenomových polypů (karcinoidní tumory, gangliocytární paragangliomy atd.).
Předpokladem správné léčby je tedy definitivní tkáňová diagnóza, ale klešťová biopsie v určitém procentu případů neumožňuje správné histologické určení léze.
K překonání této obtíže někteří autoři navrhují rozsáhlejší diagnostické a terapeutické využití ampullektomie namísto klešťové biopsie: kvalita histologických vzorků může být lepší, patologická diagnóza přesnější a potřeba nových biopsií výrazně nižší .
Další důležité těžiště stagingu představuje hodnocení intraduktálního růstu žlučových cest a/nebo pankreatu, který je mnoha autory považován za kontraindikaci endoskopické léčby; proto je u všech pacientů vyžadována endoskopická retrográdní cholangiopankreatografie (ERCP) s bočním duodenoskopem, aby bylo možné před resekcí získat cholangiogram i pankreatogram a prokázat případné intraduktální rozšíření nádoru.
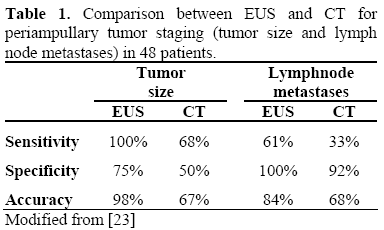
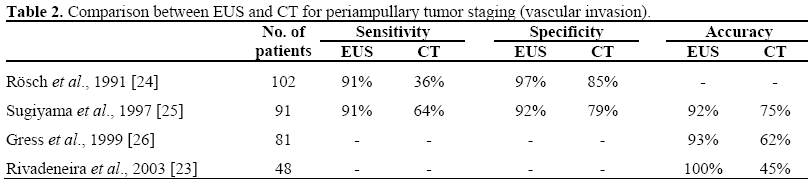
Kromě ERCP lze provést endoskopický ultrazvuk (EUS) a/nebo intraduktální ultrazvuk (IDUS), které poskytnou podrobnější a přesnější informace o rozsahu papilární léze, jako je velikost a echogenita nádoru, vrstevnaté struktury duodenální stěny a stav regionálních lymfatických uzlin. Údaje uváděné v literatuře ukázaly, že lineární EUS je lepší než spirální CT při předoperačním hodnocení velikosti nádoru, detekci regionálních uzlinových metastáz a detekci velké cévní invaze u pacientů s periampulární malignitou. Lineární array EUS zlepšila předoperační lokální staging periampulárních malignit při porovnání případů podle nálezů při operaci (tabulky 1 a 2).
Neexistuje shoda v tom, které ampulární adenomy by měly být ponechány pod dohledem a které léze by měly být odstraněny endoskopicky nebo chirurgicky.
Někteří autoři prosazují, aby byla endoskopická resekce prováděna pouze u pacientů bez známek invazivního karcinomu. Pro jiné autory není endoskopická resekce kontraindikována ani v případě průkazu dysplazie vysokého stupně.
Tabulka 3 uvádí kritéria endoskopické resekability nejčastěji uváděná v literatuře. Je třeba poznamenat, že existuje pozoruhodná variabilita kritérií pro zařazení. Někteří autoři vylučují z lokální resekce léze větší než 4-4,5 cm, zatímco jiní je zahrnují; použití fragmentární resekce, pokud je to vhodné, přispělo ke zvýšení velikosti léčených lézí: například byly úspěšně resekovány nádory o průměru až 7 cm.

Klíčový bod však představuje histologický staging ampulárních adenomů. Obecně je lokální excize akceptovanou kurativní léčbou adenomu s intraepiteliální neoplazií vysokého stupně/tumorem in situ (HGIN/Tis). U karcinomu T1, definovaného podle TNM klasifikace jako nádor omezený na ampulu nebo Oddiho svěrač, dochází k lymfovaskulární invazi nebo metastázám do lymfatických uzlin a k postižení duktů v 10-50 %, resp. 20-40 % případů. Proto je v tomto případě větší pravděpodobnost neúplné resekce a/nebo recidivy karcinomu; podobně jako u léčby adenomů tlustého střeva může být endoskopická ampullektomie kurativní u karcinomu T1 bez lymfovaskulární invaze, pokud histologické vyšetření celého resekátu potvrdí úplné odstranění .
Další důležitý bod se týká intraduktálního růstu, který se může vyskytovat jak u adenomů Tis, tak u adenomů T1 a také u adenomů s nízkým stupněm displazie. Bohnacker et al. navrhují, že v případě intraduktálního růstu u Tis a T1 se doporučuje chirurgický zákrok; u adenomů s dysplazií nízkého stupně, pokud je intraduktální růst menší než 1 cm, je stále na výběr endoskopická resekce. V každém případě zůstává operace jedinou volbou v případě neúplného odstranění a pokud je jasně přítomna malignita .
Obrázek 1 ukazuje možné vývojové schéma pro orientaci v terapeutických krocích.
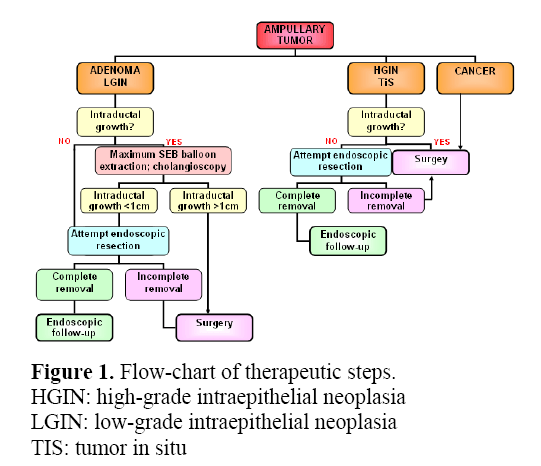
Obrázek 1. Vývojový diagram pro orientaci v terapeutických krocích.
HGIN: intraepiteliální neoplazie vysokého stupně
LGIN: intraepiteliální neoplazie nízkého stupně
TIS: tumor in situ
V případě familiární adenomatózní polypózy je třeba uvést některá doporučení. U těchto pacientů se velmi často vyvíjejí adenomy v druhé části duodena, včetně Vaterovy papily, ale pankreatoduodenektomie není vždy povinná.
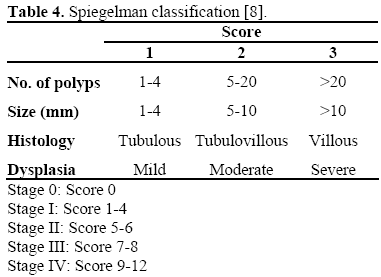
Riziko vzniku karcinomu se posuzuje podle Spigelmanovy klasifikace (tabulka 4) . Přibližně u 10-30 % pacientů s familiární adenomatózní polypózou se vyvine duodenální adenomatóza Spigelmanova stadia IV; zdá se, že mutace za kodonem 1051 jsou spojeny s těžkými periampulárními lézemi . U těchto pacientů je kumulativní riziko vzniku karcinomu 30-40 %, a proto by měla být zvážena profylaktická pankreatoduodenektomie.
Ve zbývajících stadiích lze provést endoskopickou léčbu (případně spojenou s chemoprevencí ve stadiu II-III) s pečlivým endoskopickým sledováním po kompletní excizi ampulární léze .
Technika endoskopické snare papilektomie
Technika endoskopického odstranění ampulárních adenomů zůstává nestandardizovaná, pravděpodobně kvůli relativně malému počtu zákroků tohoto typu Je důležité si uvědomit, že termín “ampulektomie“ se vztahuje na odstranění celé ampuly Vaterovy trubice a je to chirurgický termín pro zákroky, které vyžadují chirurgickou reimplantaci distálního společného žlučovodu a pankreatického vývodu ve stěně duodena.
Technicky lze při endoskopických resekcích lézí v oblasti velké papily endoskopicky odstranit pouze tkáň z papily, a proto je termín “papillektomie“ vhodnější než termín “ampullektomie“, i když se oba termíny v literatuře často používají zaměnitelně.
Duodenální papily (hlavní a vedlejší) by měly být kontrolovány pomocí endoskopu s bočním pohledem (duodenoskopu), protože papilární patologie je snadno přehlédnuta pomocí nástrojů s pohledem dopředu. Submukózní injekce před resekcí je některými autory doporučována , ale není rutinně vyžadována (podobně jako před provedením endoskopické slizniční resekce u kolorektálních polypů). Neprojevení “lift sign“ léze je spojeno s malignitou a je mnoha autory považováno za kontraindikaci pokusů o kompletní endoskopickou resekci.
Někteří badatelé naopak submukózní nástřik nedoporučují, protože může být obtížné zachytit lézi pomocí snare a protože submukózní nástřik může zastřít okraj tumoru a nezvedá žlučovod, který prochází stěnou duodena.
Endoskopická papilotomie se provádí pomocí endoskopických snare a elektrokauteru. Ve většině zpráv byly použity standardní “pletené“ snare pro polypektomii, ačkoli jsou k dispozici snare s jemným drátem speciálně určené pro ampulární resekci. Neexistují žádné důkazy dokumentující výhodu jednoho typu snare oproti druhému.
Pokud se podaří lézi zcela zachytit, lze provést en bloc resekci. En bloc resekce má tu výhodu, že potenciálně zkracuje dobu zákroku, vyžaduje méně elektrokauterizace a poskytuje kompletní vzorek tkáně pro patologické hodnocení. U lézí větších než 2 cm se však často provádí dílčí resekce, a to v případech, kdy pokus o en bloc resekci zanechal viditelnou neoplastickou tkáň na místě, nebo za účelem minimalizace rizika perforace. Při kusové resekci může dojít k elektrokauterizaci fragmentů tkáně odesílaných k patologickému vyšetření. Větší léze mohou vyžadovat více endoskopických zákroků, aby byly kompletně odstraněny. Většina publikovaných sérií uvádí použití kombinace technik en bloc a piecemeal resekce, protože typy lézí, které byly ošetřeny, byly různé velikosti a struktury. Neexistuje shoda v tom, který typ proudu by měl být při endoskopické papilotomii použit. Byl použit jak čistý řezací proud, tak smíšený proud nebo endokut a v současné době se neprokázalo, že by některý z nich byl lepší než druhý. Nastavení výkonu také není standardizováno .
Po papillektomii (en bloc nebo po částech) lze k odstranění zbývající adenomové tkáně použít Nd:YAG laser nebo argonovou plazmovou koagulaci . Pankreatická nebo biliární sfinkterotomie může pomoci při zajištění pankreatobiliární drenáže po papillektomii a může zjednodušit pokusy o zpřístupnění společného žlučovodu a pankreatického vývodu pro zavedení stentu. Mohou také pomoci při postprocedurálním endoskopickém sledování.
Několik studií prokázalo, že umístění profylaktického stentu pankreatického vývodu snižuje riziko pankreatitidy po ERCP , minimalizuje riziko stenózy ústí pankreatického vývodu a může také umožnit bezpečnější použití přídatné koagulační léčby, ale tato teorie není prokázána. Jiní obhajují zavedení pankreatického stentu pouze v případě, že pankreatický vývod po papilotomii nedrenuje .
Ve studii Zádorové a kol. byla míra pankreatitidy u pacientů, kteří podstoupili papilotomii s pankreatickým stentem a bez něj, 0 % a 20 %. Multicentrická studie zjistila, že pankreatitida po zákroku byla častější u pacientů, kterým nebyl zaveden pankreatický stent (17 % vs. 3,3 %), ačkoli tento rozdíl nebyl statisticky významný. Ve studii Chenga a kol. bylo profylaktické zavedení pankreatického stentu spojeno s nižší mírou post-ESP pankreatitidy (9,6 % vs. 25 %; P=0,33) .
Jediná prospektivní, randomizovaná, kontrolovaná studie, která hodnotila úlohu profylaktického zavedení pankreatického stentu pro snížení post-ESP pankreatitidy po endoskopické papilotomii, však prokázala statisticky významné snížení míry postprocedurální pankreatitidy ve skupině se stentem . Na základě těchto údajů se doporučuje profylaktické stentování pankreatického vývodu během papilotomie ke snížení rizika postprocedurální pankreatitidy, zatímco .nejsou k dispozici údaje o tom, jak dlouho by měl být vývod stentován .
Přestože probíhá rozsáhlá diskuse o zavádění stentů pankreatického vývodu, existuje také otázka týkající se potřeby biliární drenáže po papilotomii. Občas se objevují zprávy o zavedení biliárního stentu po endoskopické papillektomii , přičemž průměr použitého stentu se pohybuje od 7F do 10F. Nosní drenáž by mohla být platnou alternativou ke stentu umožňující rentgenovou kontrolu drenáže žlučovodu po dobu několika dnů po zákroku bez nutnosti nového endoskopického vyšetření.
Teoreticky může po endoskopické papilotomii vzniknout cholangitida stejným patogenetickým mechanismem jako pankreatitida po papilotomii a ve skutečnosti byl hlášen případ cholangitidy po endoskopické papilotomii . V každém případě profylaktické stentování žlučových cest ke snížení rizika postprocedurální cholangitidy nebylo dosud široce prováděno a nelze je v současné době jednotně doporučit, pokud není obava z nedostatečné biliární drenáže po papillektomii.
Komplikace
Endoskopické odstranění ampulárních adenomů je považováno za “vysoce rizikový“ výkon z hlediska komplikací s morbiditou 23 % (rozmezí 10-58 %) a mortalitou 0,4 % (rozmezí 0- 7 %). Míra komplikací uváděná velkými referenčními centry terciární péče a zkušenými terapeutickými endoskopisty je následující: pankreatitida 8-15 %, perforace 0-4 %, krvácení 2-13 %, cholangitida 0-2 % a papilární stenóza 0-8 %. Proto by mělo být zváženo období postprocedurálního hospitalizačního sledování za účelem detekce a léčby jakýchkoli okamžitých nebo mírně opožděných komplikací, zejména po rozsáhlém odstranění a ošetření rozsáhlých lézí, u pacientů s komorbidními onemocněními, u pacientů, kteří nemají snadný přístup k lékařské péči, a u pacientů bez podpůrných opatření.
Většina případů krvácení uváděných v literatuře se týká procedurálního krvácení a byla řešena endoskopicky během téhož výkonu. Shoda názorů panuje v tom, že by neměly být považovány za komplikace. Opožděné krvácení bylo hlášeno přibližně ve 3 % případů a obvykle bylo rovněž zvládnuto konzervativně nebo endoskopickou reintervencí. Bylo hlášeno pouze několik případů závažné pankreatitidy vyžadující delší hospitalizaci. Chirurgický zákrok je nutný jen zřídka .
Mezi pozdní komplikace patří vznik pankreatické nebo biliární stenózy; tyto komplikace se zdají být častější u pacientů bez stentů pankreatických vývodů zavedených po papilotomii (15.4 %) oproti pacientům, kteří dostali pankreatické stenty (1,1 %). Někteří autoři se domnívají, že je možné snížit míru komplikací rutinní biliární a pankreatickou sfinkterotomií, zavedením pankreatického stentu před resekcí, submukózní injekcí adrenalinu a kouskovou resekcí u větších lézí.
Výsledky endoskopické léčby
Výsledky endoskopické léčby nádorů ampuly uváděné v literatuře jsou uvedeny v tabulce 5 . Je třeba poznamenat, že ve studii Catalana a kol, byla úspěšnost spojena s vyšším věkem (54,7 vs. 46,6 let; P=0,08), menšími lézemi (21,1 vs. 29,7 mm; P<0,0001) a sporadickými lézemi (63 ze 72 vs. 20 z 31; P=0,02) .
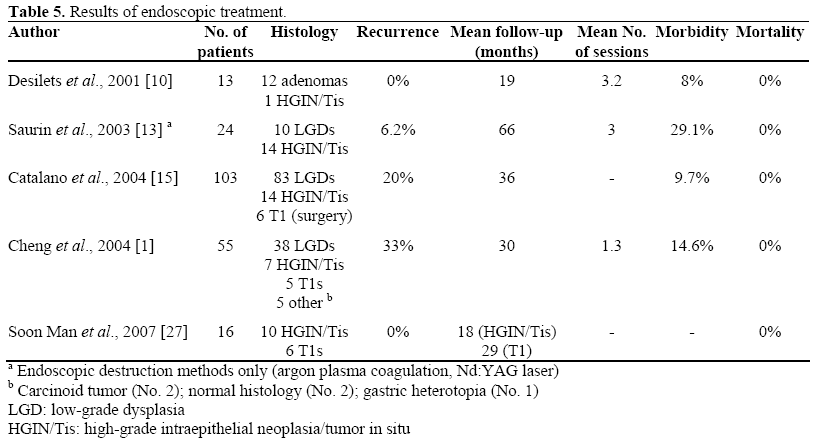
Bohnacker et al. zaměřili výsledky na přítomnost či nepřítomnost intraduktálního růstu nádoru; ve své zprávě provedené na 106 pacientech studovaných po dobu sledování s mediánem 43 měsíců autoři zjistili, že endoskopická resekce byla kurativní u 83 % pacientů bez intraduktálního růstu a u 46 % pacientů s intraduktálním růstem (P<0.001) a dospěli k závěru, že endoskopická ampullektomie je bezpečná a účinná a může být proveditelná v případě intraduktálního růstu menšího než 1 cm.
Ve studii Chenga a kol, , mělo šest pacientů (z 55 zařazených pacientů) intraduktální výrůstky: dva podstoupili chirurgickou resekci, která je považována za léčbu volby; čtyři pacienti (špatní kandidáti na operaci nebo odmítající operaci) podstoupili intraduktální terapii pomocí Nd:YAG laseru (2 pacienti) nebo endoskopickou snare resekci (2 pacienti). U těchto čtyř pacientů byl intraduktální tumor odstraněn, ačkoli u jednoho z pacientů, kteří podstoupili laserovou terapii, došlo k recidivě při průměrné době sledování 12 měsíců. Autoři proto naznačují, že u pacientů, kteří nejsou vhodní k operaci, lze intraduktální adenom eradikovat i bez ohledu na Bohnackerem udávanou hranici (nádor zasahující méně než 1 cm od žlučového ústí).
Počet recidiv uváděných v literatuře se pohybuje od 0 do 33 %; predisponující faktory se zřejmě vztahují k větší velikosti a genetické predispozici; použití adjuvantní termální ablace může snížit počet recidiv, i když je tato technika spojena také se zvyšující se morbiditou . Velmi často je však recidivující tkáň omezené velikosti, histologicky benigní, bez intraduktálního růstu, a tudíž snadno přístupná endoskopickým technikám .
Sledování po endoskopické léčbě
Optimální program sledování po kompletní excizi ampulárního tumoru není standardizován. Na základě zkušeností uvedených v literatuře se zdá být žádoucí – po dosažení kompletní excize – provádět ERCP s biopsií ampulární oblasti každých 6 měsíců po dobu 2 let.
V případech, kdy po 2 letech nedojde k recidivě, by mělo být endoskopické sledování prováděno častěji u pacientů s familiární adenomatózní polypózou než u pacientů se sporadickými lézemi, a to z důvodu vysoké prevalence duodenálních adenomů a rizika periampulárního karcinomu. Proto by pacienti s familiární adenomatózní polypózou měli endoskopii podstupovat v tříletých intervalech, zatímco ostatní pacienti by měli endoskopii opakovat pouze v případě výskytu symptomů .
Závěry
Endoskopická léčba adenomů velké duodenální papily je bezpečnou, dobře tolerovanou alternativou chirurgické léčby. V rukou odborníků jsou komplikace vzácné a chirurgický zákrok zpravidla není nutný. Vhodní pacienti musí být pečlivě vybíráni a musí být zajištěno endoskopické sledování. Ke stanovení skutečné míry recidivy (v literatuře 33 %) a dlouhodobých výsledků endoskopického ústupu je třeba delšího sledování .
Konflikt zájmů
Autoři nemají žádný potenciální konflikt zájmů
- Cheng CL, Sherman S, Fogel EL, McHenry L, Watkins JL, Fukushima T, et al. Endoscopic snare papillectomy for tumors of the duodenal papillae. Gastrointest Endosc 2004; 60:757-64.
- Yeo CJ, Cameron JL, Sohn TA, Lillemoe KD, Pitt HA, Talamini MA, et al. Six hundred fifty consecutive pancreaticoduodenectomies in the 1990s: pathology, complications, and outcomes. Ann Surg 1997; 226:248-60.
- Bohnacker S, Soehendra N, Maguchi H, Chung JB, Howell DA. Endoskopická resekce benigních nádorů vaterské papily. Endoscopy 2006; 38:521-5.
- Standards of Practice Committee, Adler DG, Qureshi W, Davila R, Gan SI, Lichtenstein D, et al. The role of endoscopy in ampullary and duodenal adenomas. Gastrointest Endosc 2006; 64:849-54.
- Elek G, Gyôri S, Tóth B, Pap A. Histologické hodnocení předoperačních biopsií z ampulla vateri. Pathol Oncol Res 2003; 9:32-41.
- Seewald S, Omar S, Soehendra N. Endoskopická resekce nádorů ampuly Vater: jak daleko nahoru a jak hluboko dolů můžeme jít? Gastrointest Endosc 2006; 63:783-8.
- Bohnacker S, Seitz U, Nguyen D, Thonke F, Seewald S, deWeerth A, et al. Endoskopická resekce benigních nádorů duodenální papily bez a s intraduktálním růstem. Gastrointest Endosc 2005; 62:551- 60.
- Groves CJ, Saunders BP, Spigelman AD, Phillips RK. Karcinom dvanáctníku u pacientů s familiární adenomatózní polypózou (FAP): výsledky desetileté prospektivní studie. Gut 2002; 50:636-41.
- Björk J, Akerbrant H, Iselius L, Bergman A, Engwall Y, Wahlström J, et al. Periampullary adenomas and adenocarcinomas in familial adenomatous polyposis: cumulative risks and APC gene mutations. Gastroenterology 2001; 121:1246-8.
- Desilets DJ, Dy RM, Ku PM, Hanson BL, Elton E, Mattia A, Howell DA. Endoskopická léčba nádorů velké duodenální papily: zdokonalené techniky ke zlepšení výsledků a předcházení komplikacím. Gastrointest Endosc 2001; 54:202-8.
- Eswaran SL, Sanders M, Bernadino KP, Ansari A, Lawrence C, Stefan A, et al. Success and complications of endoscopic removal of giant duodenal and ampullary polyps: a comparative series. Gastrointest Endosc 2006; 64:925-32.
- Norton ID, Gostout CJ, Baron TH, Geller A, Petersen BT, Wiersema MJ. Bezpečnost a výsledky endoskopické snare excize velké duodenální papily. Gastrointest Endosc 2002; 56:239-43.
- Saurin JC, Chavaillon A, Napoléon B, Descos F, Bory R, Berger F, Ponchon T. Long-term follow-up of patients with endoscopic treatment of sporadic adenomas of the papilla of vater. Endoscopy 2003; 35:402-6.
- Martin JA, Haber GB, Kortan PP, Raijman I, Abedi M, DuVall GA. Endoskopická snare ampullektomie pro resekci benigních ampulárních neoplazií. Gastrointest Endosc 1997; 45:AB139.
- Catalano MF, Linder JD, Chak A, Sivak MV Jr, Raijman I, Geenen JE, Howell DA. Endoskopická léčba adenomu velké duodenální papily. Gastrointest Endosc 2004; 59:225-32.
- Binmoeller KF, Boaventura S, Ramsperger K, Soehendra N. Endoscopic snare excision of benign adenomas of the papilla of Vater. Gastrointest Endosc 1993; 39:127-31.
- Zádorová Z, Dvofák M, Hajer J. Endoskopická léčba benigních nádorů Vaterovy papily. Endoscopy 2001; 33:345-7.
- Tarnasky PR, Palesch YY, Cunningham JT, Mauldin PD, Cotton PB, Hawes RH. Pankreatický stenting zabraňuje pankreatitidě po biliární sfinkterotomii u pacientů s dysfunkcí Oddiho svěrače. Gastroenterology 1998; 115:1518-24.
- Fazel A, Quadri A, Catalano MF, Meyerson SM, Geenen JE. Zabrání stent pankreatického vývodu pankreatitidě po ERCP? Prospektivní randomizovaná studie. Gastrointest Endosc 2003; 57:291-4.
- Harewood GC, Pochron NL, Gostout CJ. Prospektivní, randomizovaná, kontrolovaná studie profylaktického zavedení pankreatického stentu při endoskopické snare excizi duodenální ampuly. Gastrointest Endosc 2005; 62:367-70.
- Choi JJ, Kim MH, Kim GD, Kim JK, Park JT, Oh DR, Seo WJ, et al. Papilární stenóza a cholangitida způsobená endoskopickou slizniční resekcí adenomu ampuly. Korean J Gastrointest Endosc 2003; 27:249- 53.
- Katsinelos P, Paroutoglou G, Kountouras J, Beltsis A, Papaziogas B, Mimidis K, et al. Safety and longterm follow-up of endoscopic snare excision of ampullary adenomas. Surg Endosc 2006; 20:608-13.
- Rivadeneira DE, Pochapin M, Grobmyer SR, Lieberman MD, Christos PJ, Jacobson I, Daly JM. Srovnání endoskopického ultrazvuku s lineárním uspořádáním a spirální počítačové tomografie pro staging periampulárních malignit. Ann Surg Oncol 2003; 10:890-7.
- Rösch T, Lorenz R, Braig C, Feuerbach S, Siewert JR, Schusdziarra V, Classen M. Endoscopic ultrasound in pancreatic tumor diagnosis. Gastrointest Endosc 1991; 37:347-52.
- Sugiyama M, Hagi H, Atomi Y, Saito M. Diagnosis of portal venous invasion by pancreatobiliary carcinoma: value of endoscopic ultrasonography. Abdom Imaging 1997; 22:434-8.
- Gress FG, Hawes RH, Savides TJ, Ikenberry SO, Cummings O, Kopecky K, et al. Role EUS v předoperačním stagingu karcinomu pankreatu: velké zkušenosti z jednoho centra. Gastrointest Endosc 1999; 50:786-91.
- Yoon SM, Kim MH, Kim MJ, Jang SJ, Lee TY, Kwon S, et al. Gastrointest Endosc 2007; 66:701-7.