Aorto-atrial fistula formation and closure: a systematic review
Introduzione
La presenza di flusso di sangue tra l’aorta e l’atrio è una condizione patologica rara ma complessa, nota anche come fistola aorto-atriale (AAF). Sintomi sistemici come insufficienza cardiaca, debolezza ed edema possono verificarsi così come sintomi più locali tra cui dispnea, dolore toracico, palpitazioni e affaticamento o tosse.
L’esatta incidenza della AAF è attualmente sconosciuta e ci sono molte lacune nella nostra conoscenza per quanto riguarda vari aspetti della AAF, come le strategie di diagnosi e le opzioni di gestione. Lo scopo del presente studio è stato quello di rivedere sistematicamente la letteratura disponibile sui casi di AAF. Questi dati forniranno una panoramica delle caratteristiche demografiche dell’AAF, le tecniche di imaging preoperatorie utilizzate per diagnosticare l’AAF, l’anatomia e le cause dell’AAF e infine forniranno alcune informazioni sulle opzioni terapeutiche per l’AAF e i rispettivi risultati. Questi dati dovrebbero consentire ai chirurghi di prevenire l’insorgere di questa condizione inizialmente, nonché di trattarla in modo ottimale quando si verifica.
Acquisizione delle prove
Abbiamo esaminato sistematicamente la letteratura sulla formazione e la chiusura dell’AAF. Sono state eseguite ricerche separate su Medline (PubMed), EMBASE e database Cochrane. Sono stati utilizzati i seguenti titoli MESH: atrio, ventricolo, fistola, cardiaca, shunt, aortica, tunnel aorto-atriale e fistola coronarica camerale. Tutti gli articoli sono stati considerati per l’analisi, indipendentemente dalla loro qualità o dalla rivista in cui sono stati pubblicati. Sono stati utilizzati criteri rigorosi e lo screening dei titoli e degli abstract per selezionare gli articoli pertinenti. Sono stati inclusi tutti gli articoli e i rapporti sulla formazione e la chiusura dell’AAF. I rapporti non scritti in inglese sono stati esclusi, così come i rapporti senza una chiara descrizione dell’AAF o della chiusura dell’AAF. Non sono stati identificati studi controllati randomizzati o studi clinici. Abbiamo valutato i restanti rapporti di casi. Abbiamo identificato 132 case report con un totale di 136 pazienti per la nostra analisi (Figura 1). In ciascuno di questi rapporti abbiamo estratto le seguenti informazioni: anno di pubblicazione, numero di pazienti, età, sesso, precedente intervento cardiaco, tempo tra l’intervento e la formazione dell’AAF, tratto della fistola, presunta causa dell’AAF, tecnica chirurgica per la chiusura dell’AAF, follow-up e risultato (Tabella 1).


Tabella completa
Sintesi delle prove
Demografia
Il 7% degli articoli studiati è stato pubblicato nel periodo dal 1960 al 1980. Circa il 70% degli articoli sono stati pubblicati dopo il 2000, mentre circa il 35% sono stati pubblicati dopo il 2010 (Figura 2A). La maggior parte dei rapporti sui casi di AAF proveniva dagli Stati Uniti d’America (39 casi) seguiti dal Regno Unito (12 casi). La maggior parte delle pubblicazioni asiatiche proveniva dall’India (11 casi), dal Giappone (12 casi) e dalla Turchia (12 casi). Dai 136 casi analizzati, l’insorgenza dell’AAF aveva un rapporto uomo-donna di circa 2:1. L’età dei pazienti nei casi descritti variava tra 5 giorni e 85 anni (mediana 51 anni, media 46 anni) (Figura 2B).

Imaging
In 130 dei 136 casi sono state fornite informazioni sull’uso di tecniche di imaging preoperatorio. Nella maggior parte dei casi in cui è stato utilizzato l’imaging, sono state preferite l’ecocardiografia (83,1%) e l’angiografia (59,6%) (Tabelle 2 e 3). Dei 113 casi riportati in cui è stata utilizzata l’ecocardiografia, l’uso della transtoracica (23,9%) e della transesofagea (24,8%) o la combinazione di entrambe (23,0%) sembra essere equamente distribuita, mentre nel 28,3% dei casi la tecnica utilizzata dagli autori non è stata specificata (Tabella 3).

Tabella completa

Tabella completa
Anatomia
La formazione della fistola dall’aorta ascendente agli atri si è verificata più spesso nell’atrio destro (86 dei 136 casi) rispetto all’atrio sinistro (41 dei 136 casi), con un rapporto LA/RA di 1:2.1. In due pazienti, il tratto di fistola ha avuto origine dall’aorta discendente nell’atrio sinistro (DescAo-LA) (1,2). Alcuni casi molto rari includevano la formazione di fistole dall’aorta discendente nell’atrio destro (DescAo-RA) (3), la formazione di fistole sia nell’atrio sinistro che in quello destro (4,5) e la formazione di fistole tra l’aorta ascendente, l’atrio destro e il ventricolo destro (6-8) e la formazione di fistole tra l’aorta ascendente, l’atrio sinistro e il ventricolo sinistro (9) (Figure 3,4 e Tabella 4).


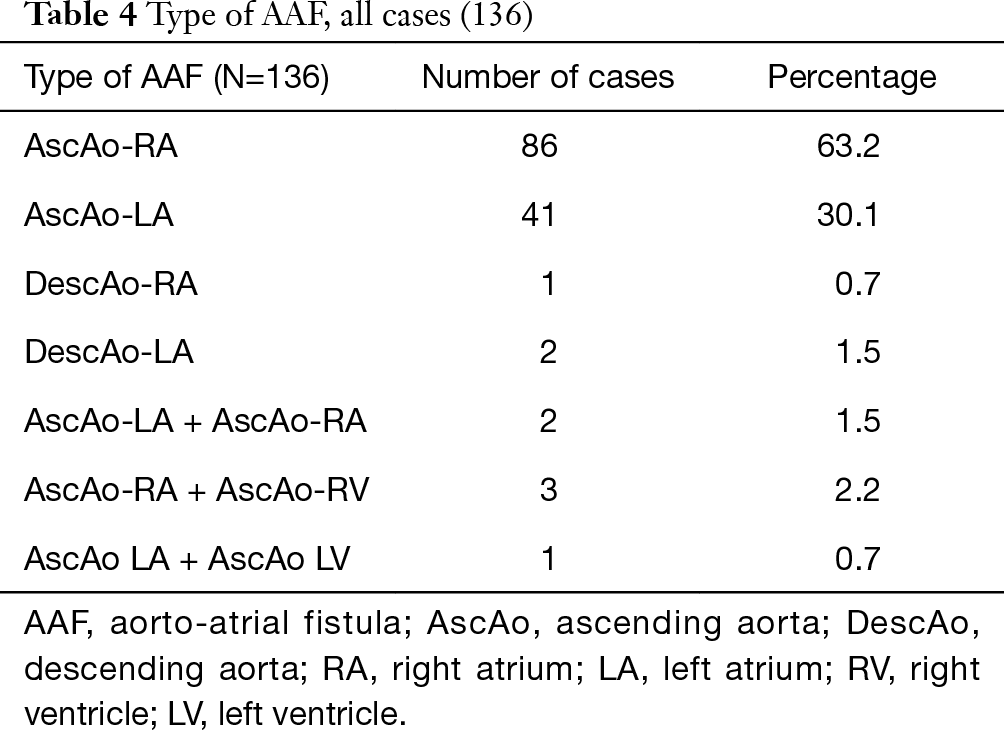
Tabella completa
Cause
Nella maggior parte dei casi (22,8%) l’endocardite era la causa della formazione di AAF. Nel 71% di questi casi, era presente anche un ascesso paravalvolare. Inoltre, il 45,2% di questi pazienti aveva subito un precedente intervento chirurgico con una valvola protesica. Gli aneurismi aortici (22,1%), principalmente complicati da pareti aortiche dissecate, erano la seconda causa più comune. Anche le cause congenite (11,8%) erano responsabili di un certo numero di AAF. In questo gruppo, l’81,2% dei tratti di fistola andava dall’aorta all’atrio destro, mentre solo il 18,8% portava all’atrio sinistro. È interessante notare che i traumi al torace erano una causa relativamente rara di AAF, essendo questa la causa in appena il 3,7% di tutti i casi riportati.
Nel 15,4% dei casi la formazione della fistola era secondaria a un intervento di chirurgia cardiaca. Gli aneurismi dell’innesto della vena safena (SVG) dopo un intervento di bypass coronarico sono stati responsabili del 9,6% delle formazioni di AAF nei casi riportati. Inoltre, nel 7,4% dei casi una precedente chiusura del difetto del setto atriale con un dispositivo era responsabile di AAF (Tabella 5).

Tabella completa
Terapia
Come mostrato nella Tabella 6, AAF è stata corretta tramite un approccio chirurgico aperto nel 73,5% dei casi. Nel 10,3% la fistola è stata chiusa tramite un intervento percutaneo, mentre nel 4,4% dei casi è stato consigliato un approccio medico conservativo (ad esempio, diuretici e trasfusioni di sangue), a causa dell’elevato rischio chirurgico. In un caso il paziente è stato programmato per la chiusura chirurgica della fistola, ma l’ecocardiografia ha mostrato una chiusura spontanea. Nel 3,6% dei casi il paziente ha rifiutato l’intervento chirurgico correttivo e nel 5,1% di tutti i casi il paziente è morto prima di poter procedere con l’intervento. Nell’1,5% di tutti i casi con AAF non è stata eseguita alcuna procedura o intervento medico, a causa di un rischio operativo molto elevato o perché la fistola non aveva effetti emodinamici. Nello 0,7% dei casi il trattamento dell’AAF non è stato descritto. Nel 42% dei casi in cui è stato utilizzato un approccio chirurgico, la fistola è stata chiusa con suture. Nel 20% dei casi si è scelto di chiudere la fistola con un cerotto, mentre nel 4% il tratto è stato legato. Un approccio combinato di sutura e uso di cerotti si è verificato nel 5% dei casi. La tecnica di chiusura durante la chirurgia correttiva non è stata descritta nel 29% dei casi (Tabella 6). Quando è stata impiegata la chiusura percutanea del tratto di fistola, la chiusura con un dispositivo Amplatzer è stato il trattamento di scelta (71,4%), seguito dall’embolizzazione con bobina (14,3%), dagli stent coperti (7,15%) e infine dalla chiusura con palloncino (7,15%) (Tabella 6).

Tabella completa
Risultati
Nel 74,3% di tutti i casi studiati la riparazione della fistola è riuscita e i pazienti sono sopravvissuti alle procedure. Nel 14,7% dei casi i pazienti non sono sopravvissuti, mentre nell’11,0% dei casi riportati l’esito del paziente non è stato menzionato. Nell’83% di tutti i casi chirurgici la riparazione della fistola ha avuto successo e i pazienti sono sopravvissuti alle procedure. Nell’85,7% di tutte le correzioni percutanee della fistola, la riparazione ha avuto successo e i pazienti sono sopravvissuti alle procedure (Tabella 7).

Tabella completa
Discussione
Abbiamo esaminato sistematicamente la letteratura per i rapporti sull’AAF. Non abbiamo identificato alcun rapporto su registri sistematici o studi clinici che indagano l’AAF. Tutte le nostre conoscenze sull’AFF sono quindi attualmente basate su rapporti di casi. Sulla base dei casi riportati, concludiamo che:
- Le AAF piccole possono essere asintomatiche e possono essere affrontate in modo conservativo con la riduzione del postcarico cardiaco e l’uso di diuretici. In questi casi, si raccomanda vivamente di osservare attentamente il paziente nel tempo e, se le condizioni cliniche si deteriorano, si dovrebbe considerare la chiusura attiva della fistola.
- Le AAF grandi richiedono una chiusura immediata per via percutanea o tramite un approccio chirurgico. La chiusura spontanea di un AAF è molto rara e il trattamento conservativo deve essere fortemente sconsigliato nei casi con fistole di grandi dimensioni o in presenza di sintomi clinici.
- Anche se il volume di casi è basso, rispetto alla chirurgia, la chiusura percutanea ha mostrato risultati comparabili.
L’approccio chirurgico per chiudere la fistola spesso comporta la sutura o l’uso di un patch. La chiusura percutanea dell’AAF è stata impiegata più spesso negli ultimi anni. Non esistono dispositivi specifici per la chiusura transcatetere delle fistole, ma dispositivi come l’Amplatzer Septal Occluder, utilizzato per chiudere i difetti del setto atriale, hanno dimostrato la loro applicabilità a questo scopo. I tassi complessivi di successo del trattamento sono almeno del 70% con un tasso di mortalità di circa il 15%.
Ci sono una serie di limitazioni al nostro studio, con la principale limitazione che i dati riportati provengono da case report o serie di casi. Per questi motivi, è probabile che ci sia un certo bias di pubblicazione in quanto è altamente probabile che non tutti i casi siano stati pubblicati. Inoltre, i casi di pazienti che sono stati trattati senza successo hanno meno probabilità di essere riportati. Mancano dati da popolazioni più ampie, il che significa che attualmente non esistono dati specifici sull’incidenza e la prevalenza. Questa revisione ci fornisce una serie di informazioni sulla comparsa e la fisiopatologia dell’AAF, così come le attuali opzioni di trattamento per questa rara, ma potenzialmente pericolosa, condizione.
Riconoscimenti
Nessuno.
Footnote
Conflitti di interesse: Gli autori non hanno conflitti di interesse da dichiarare.
- Nihoyannopoulos P, Sapsford R, Oakley CM. Fistola congenita tra l’aorta e l’atrio sinistro. Br Heart J 1987;57:387-90.
- Sarkar AK, Sanjeeva NG, Waghmare NS. Associazione di fistola congenita discendente aorto-sinistra atriale con la finestra aortopolmonare e difetto del setto atriale. Cardiol Young 2014;24:143-4.
- Elwatidy AF, Galal AN, Rhydderch D, et al. Fistola atriale aorto-destra. Ann Thorac Surg 2003;76:929-31.
- Dalla Pozza R, Kozlik-Feldmann R, Le TP, et al. Chiusura interventistica di due fistole dopo chirurgia della valvola aortica. Clin Res Cardiol 2009;98:451-4.
- Sabzi F, Heidari A, Faraji R. Un raro caso di fistola aortica dei seni di valsalva a più camere cardiache secondaria alla formazione di ascesso aortico periannulare da endocardite Brucella sottostante. GMS Hyg Infect Control 2015;10:Doc14.
- Moral S, Aboal J, Morales M. Fistola multipla aorto-cavitaria destra: una rara complicazione dell’endocardite valvolare prostetica nei consumatori di droghe per via endovenosa. Eur J Echocardiogr 2009;10:374-5.
- Gunarathne A, Hunt J, Gershlick A. Aorto-right atriale e ventricolare destro fistole: una complicazione molto rara di endocardite valvola aortica bicuspide nativa. Cuore 2013;99:1708.
- Patel V, Fontana A, Guglin M, et al. Ecocardiografia transtoracica tridimensionale nell’identificazione di fistola atriale aorto-destra e fistole ventricolari aorto-destra. Echocardiography 2010;27:E105-8.
- Hachida M, Koyanagi H, Hanayama N, et al. Ricostruzione di successo della fistola atriale aorto-sinistra dopo la sostituzione della valvola aortica e allargamento della radice con la procedura Manouguian. J Card Surg 1994;9:392-8.