Frontiers in Cellularand Infection Microbiology
Introduction
A Bacteroides fragilis, amely az ember és a haszonállatok gyomor-bélflórájában található, egy anaerob baktérium. Az egyik kiemelkedő humán komensál és az egyik leggyakrabban izolált Bacteroides a klinikai mintákból, amely hasmenést, hashártyagyulladást, intraabdominális tályogokat, szepszist és endogén gennyes fertőzéseket okoz (Sears et al., 1995, 2014).
Kimutatták, hogy a B. fragilis megelőzi a bélrendszeri gyulladásos betegségeket vastagbélgyulladásban szenvedő állatokban az immunmoduláló molekula poliszacharid A (PSA) termelésének köszönhetően, amely gyulladásellenes immunválaszt indukál a bélszövetben (Mazmanian et al., 2008; Lee et al., 2018). A B. fragilis patogenitása több tényezőnek köszönhető, többek között a kapszulának, a külső membránfehérjéknek (OMP) és speciális enzimeknek, amelyek egy 20 kDa-os metalloproteázból, a Bacteroides fragilis toxinból (BFT) állnak (Sears et al, 1995, 2014).
A BFT-t termelő B. fragilis, az enterotoxigén B. fragilis (ETBF), emberekben és állatokban hasmenéses megbetegedések okozójaként ismert (Myers et al., 1987; Purcell et al., 2017). Az ETBF a gyulladásos bélbetegségek (IBD) kockázati tényezőjeként ismert, és jelen van a betegek székletében és biopsziás mintáiban (Prindiville et al., 2000; Basset et al., 2004; Zamani et al., 2017). Kimutatták, hogy a BFT expressziója hasítja az E-kadherin extracelluláris doménjét, amely a zonula adherens egyik fő szerkezeti alkotóeleme, és a sejtadhézióért felelős. Továbbá a BFT képes aktiválni a B-katenin jelátvitelt és IL8 szekréciót indukálni a vastagbél epitélsejtekben (Wu és mtsai., 1998). Egy tanulmány szerint a HT29/C1 sejtek BFT kezelését követően a membránhoz kapcsolódó E-kadherin elvesztése a ß-katenin nukleáris lokalizációját indította el, ami a c-myc transzlációt indukálta és tartós sejtproliferációhoz vezetett (Wu és mtsai., 2003). A BFT hatásossága és a gasztrointesztinális epitélszerkezetre és fiziológiára gyakorolt hatása arra utal, hogy az ETBF jelenléte hozzájárulhat a krónikus vastagbélbetegségekhez, beleértve az onkogén transzformációt, a bélgyulladást, a krónikus vastagbél diszfunkciókat és a vastagbél prekancerosus és rákos elváltozásait (Wu et al., 1998, 2003; Sears et al., 2014).
A kolorektális rák (CRC) az egyik legelterjedtebb rákos megbetegedés világszerte, az összes rákos megbetegedés 9%-át teszi ki, és világszerte a negyedik oka a rák okozta halálozásnak (Sears et al., 1995; Ferlay et al., 2015). Az egyes országok között azonban jelentős különbség van e daganatos megbetegedés életkor szerinti standardizált előfordulási gyakoriságában; az USA és az európai országok előfordulási aránya több mint 25-szöröse az afrikai és ázsiai országokénak. A CRC megbetegedési és halálozási aránya az utóbbi években csökkent, köszönhetően a továbbfejlesztett szűrővizsgálatoknak, amelyekkel a vastagbélrendszeri elváltozásokat korábbi stádiumban lehet felismerni, valamint a gyógyszeres kezelés és az eljárások fejlesztésének (Boyle és Langman, 2000; Rafiemanesh et al, 2016).
A CRC az egyik leggyakoribb rákos megbetegedés Iránban, és az iráni férfiak körében a harmadik leggyakoribb rákos megbetegedés (8,1-8,3/100 000 lakosra), az iráni nők körében pedig a negyedik leggyakoribb (6,5-7,5/100 000 lakosra) (Moghimi-Dehkordi et al., 2008; Kolahdoozan et al., 2010). A CRC kockázati tényezői az elhízás, a mozgásszegény életmód, a magas zsírtartalmú étrend, a kevés zöldséget és gyümölcsöt tartalmazó étrend, a dohányzás, az alkoholfogyasztás és a nem szteroid gyulladáscsökkentők (NSAID). A krónikus gyulladás, az IBD, a polipok, az adenóma és a diszplázia elváltozásokat okoz a vastagbélsejtekben, és rákra hajlamossá teszi őket (Boyle és Langman, 2000; Johnson és mtsai., 2013).
A CRC előfordulása és halálozása a fejlett nyugati országokban csökken, míg Iránban az utóbbi évtizedekben az életmód és a táplálkozás változásai miatt mindkét nemnél nő az előfordulása. A csökkenés másik oka lehet a létesítmények számának növekedése, valamint a berendezések és a technológia fejlődése, mivel több ember fordul szűrővizsgálatra az egészségügyi intézményekhez, míg korábban előfordulhatott, hogy egy személynek rákja volt, és akár meg is halt, de a rákot nem diagnosztizálták a berendezések és a létesítmények hiánya miatt (Malekzadeh et al., 2009; Siegel et al, 2014).
Ebben a tanulmányban a CRC-ben és rákot megelőző állapotokban szenvedő betegek biopsziás mintáiban az ETBF gyakoriságát és abundanciáját hasonlítottuk össze olyan egyénekével, akiknek nem volt személyes vagy családi kórtörténetében vastagbélbetegség, hogy megvizsgáljuk a BFT jelenléte és a tumor kialakulása közötti összefüggést.
Anyagok és módszerek
Betegek és minták
Ebben az esetkontrollvizsgálatban 120 nyálkahártya-biopsziát gyűjtöttünk kolonoszkópia segítségével prekancerózus és CRC állapotú iráni betegektől (n = 68) és a kontrollcsoporttól (n = 52). A prekancerosus betegek (Serrated lesions, Adenoma include Low-grade Dysplasia: LGD és magas fokú diszplázia: HGD) és rákos állapotok (kolorektális rák: CRC), akiket 2015 márciusa és 2017 januárja között a teheráni Imam Khomeini kórházba utaltak, kiválasztottak a vizsgálatban való részvételre. A Teheráni Orvostudományi Egyetem Etikai Bizottsága jóváhagyta a vizsgálati protokollt. Emellett minden résztvevőtől tájékozott beleegyezést szereztek be. Minden beteget a klinikai tünetek, valamint a szövettani és radiológiai szabványok alapján diagnosztizáltak, amelyek különleges eloszlású tipikus jellemzőket mutattak (Swiderska et al., 2014). Az életkorra, nemre és az elváltozások típusára vonatkozó összes adatot a betegek nyilvántartásából szereztük be. A vizsgálatba bekerülő összes beteget a kolonoszkópia idején diagnosztizálták, és a kemoterápia nem kezdődött meg a kezelésükre.
A vizsgálatba ugyanebben az időszakban 52 egészséges kontrollt vontak be kontrollként, akiknek sem személyes, sem családi kórtörténetében nem szerepelt diagnosztizált kolorektális betegség, és akiknek életkora és neme megegyezett a betegekével. A kontrollok esetében kizáró kritérium volt a közelmúltban előfordult hasmenés és IBD. A vizsgálatban részt vevő személyek egyike sem használt antibiotikumot vagy probiotikumot az elmúlt 3 hónapban. Valamennyi mintát tioglikollát táptalajt (Merck, Németország) tartalmazó steril tartályban tartották, és anaerob állapotban szállították a laboratóriumba azonnali kezelésre. Emellett minden betegtől 2 nyálkahártya-biopsziát vettek tenyésztés és DNS-kivonás céljából.
Bakteriális tenyésztés
Két üveghomogenizálót használtak mechanikus bontáshoz és homogenizáláshoz az összes biopszia esetében; majd Bacteroides Bile Esculin agar (BBE) (Himedia Laboratories Pvt. Ltd, India) táptalajon tenyésztették őket. Ebben a vizsgálatban Anoxomat rendszert (MART Microbiology Drachten, Hollandia) használtunk az anaerobok számára gázos légköri körülmények biztosításához; majd a lemezeket anaerob kamrában inkubáltuk 37°C-on 72 órán keresztül. 72 órán keresztül a B. fragilis-t továbbá valós idejű PCR módszerrel igazoltuk.
DNS extrakció
A DNS-t közvetlenül a biopsziaszövetből nyertük az RTP® Mycobacteria Kit (Invitek, Berlin, Németország) segítségével. A kivont DNS optikai sűrűségét (OD) 260 nanométeren határoztuk meg. Ezután a DNS-t -20°C-on tartósítottuk a későbbi elemzéshez és a valós idejű PCR-hez.
Real-Time PCR
A bft és a 16S rRNS gén szekvenciáit a génbankból nyertük vissza. A primereket és a szondákat a primer 3 plus (http://www.bioinformatics.nl/cgi-bin/primer3plus/primer3plus.cgi) segítségével terveztük. Az összes bft géntípus kimutatására használt primert és szondát korábbi tanulmányunkban (Zamani et al., 2017) terveztük. A bft gén altípusok kimutatásához a valós idejű PCR-t a korábban leírtak szerint végeztük (Merino et al., 2011).
Pozitív kontrollként az ETBF D-134 törzs genomiális DNS-ét és a RIGLD 1 klónt használtuk (Rashidan et al., 2018). A negatív kontroll PCR TaqMan master mix volt, DNS helyett desztillált vízzel.
Az amplifikációhoz standard DNS-t készítettünk, és a templát grammonkénti molekuláinak számát a meghatározott képlet alapján számoltuk ki (Zamani et al., 2017). A bft és a 16S rRNS gén standard görbéjét minden egyes primer és szonda felhasználásával a B. fragilis DNS-minták 10-szeres sorozathígításával értékeltük, ami a biopsziák grammonkénti 101-106 átlagértékének felel meg.
A standard görbe és az y-intercept alapján azokat a mintákat, amelyeknél a fluoreszcens jel nem mutatta a 38-as Ct értéknél korábban a fluoreszcens jelet, negatívnak minősítettük. Azokat a mintákat is hígítottuk, amelyek ≤ 10 Ct értékű fluoreszcenciát produkáltak. A valós idejű PCR hatékonyságát az E = 10(-1/slop) – 1 (Zamani et al., 2017) értékkel határoztuk meg.
A standardgörbék optimalizálása után a hígítási sorozatot minden egyes amplifikációs futtatásba beletettük. A valós idejű PCR-teszteket a LinGene K Real Time PCR eszközzel (Bioer, Hangzhou, PR, Kína) értékeltük ki. Minden tesztet 25 μL térfogatban végeztünk (Zamani et al., 2017). A minőség biztosítása érdekében minden kísérletet másodszor is megismételtünk egymástól függetlenül, és az átlagokat jelentettük.
A PCR specificitásának és a termék várható méretének ellenőrzésére a primereket hagyományos PCR-ben alkalmaztuk, és az amplikonokat agarózgélen futtattuk. Ezenkívül a pozitívan amplifikált fragmentumok specificitását szekvenálással igazoltuk. A PCR-terméket elküldtük a dél-koreai Macrogen Corporationnek szekvenálásra. A szekvenálási eredményeket a Chromas 2.6 szoftverrel elemezték. Ezután az összes szekvenciát az NCBI adatbázisában (https://blast.ncbi.nlm.nih.gov/Blast.cgi) blastolták. Az összes szekvenált izolátum esetében az NCBI adatbázisban található rokon génekkel (16s rRNS gén és bft gén) való hasonlóság százalékos aránya több mint 95% volt.
Statisztikai elemzés
Az eredményeket Fisher egzakt, Chi-négyzet és Mann-Whitney tesztek segítségével hasonlítottuk össze. A P < 0,05 értéket statisztikailag szignifikánsnak tekintettük. A B. fragilis és az ETBF esetében is kiszámítottuk az átlagértékek ± az átlag Std. error of mean (SEM) értékeit. Az adatokat az SPSS 13.0 statisztikai szoftverrel elemeztük.
Ebben a vizsgálatban feltételes logisztikus regressziót használtunk az esélyhányadosok (OR) és a 95%-os konfidenciaintervallumok értékelésére. Ebben a konstrukcióban az esélyhányados konzisztens becslője a CRC arányának, ha ETBF-expozíciónak vannak kitéve a nem exponált alanyokhoz képest.
Eredmények
Ebben a vizsgálatban 68 mintát gyűjtöttek CRC-betegektől (36 férfi és 32 nő; átlagéletkor: 55 év; tartomány: 35-78) és 52 mintát egészséges kontrolloktól (HC) (30 férfi és 22 nő; átlagéletkor: 56 év; tartomány: 42-78). Valamennyi betegnél a mintavétel időpontjában végzett kolonoszkópiás vizsgálat alapján állították fel a diagnózist. A kolonoszkópia időpontjában diagnosztizált összes betegből 26 betegnél invazív CRC, 18 betegnél serrated elváltozás, 24 betegnél adenoma, 14 betegnél LGD és 10 betegnél HGD volt a jelenlegi besorolás szerint (1. ábra). Ezeket a biopsziákat 22, 32, illetve 14 betegnél a jobb oldalról (felszálló), a bal oldalról (leszálló) és mindkét oldalról vették (1. táblázat).
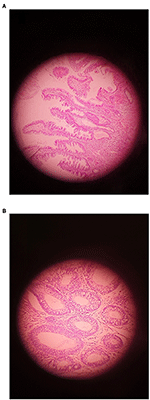
1. ábra. Egy példa adenomára, melyen (A) LGD és (B) HGD látható (eredeti nagyítás ×400).
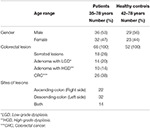
1. táblázat. A betegek és a HC jellemzői.
A B. fragilis tenyésztés eredménye 31(51%) és 25 (48%) minta esetében volt pozitív a betegek és az egészséges kontrollok esetében (2. táblázat) (P = 0,7).

2. táblázat. A Bacteroides fragilis tenyésztés adatai.
A standard görbe szerint az ETBF (kontroll pozitív) DNS 101, 102, 103, 104, 105 és 106-os hígításai 15,08 ± 0,1, 18,04 ± 0,2, 21,42 ± 0,2, 25,02 ± 0,2, 28,02 ± 0,4 és 31,96 ± 0,4 Ct-értékeket adtak. A valós idejű PCR hatékonysága 98 és 100% között volt.
A 16S rRNS gén és a bft gén tekintetében a pozitív minták aránya 63 és 47% volt a betegeknél. Ugyanakkor a HC-minták 81, illetve 3,8%-a mutatott pozitív eredményt (3. táblázat). A bft gén pozitivitása közötti különbség a betegek és a HC esetében statisztikailag szignifikáns volt (P = 0,00).
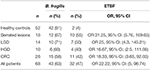
3. táblázat. A 16S rRNS gén és a bft gének pozitív mintáinak száma a klinikopatológiai csoportokban és a HC-ban.
A 3. táblázatban látható a bft gén pozitív minták száma a CRC-ben és a HC-ban a klinikopatológiai csoportokon belül. A legmagasabb OR-t a serrated elváltozások csoportjában találták, amelyet az LGD-vel járó adenomatosus elváltozások csoportja követett. Szintén az összes betegre vonatkozó OR (OR 22,22, 95% CI: 5, 98,74) írta le az ETBF és az elváltozások megléte közötti összefüggést.
A valós idejű PCR kvantitatív elemzésének eredményeit a B. fragilis 16S rRNS génre és az ETBF bft génre számolt ng DNS-re vonatkoztatva a 4. táblázat mutatja. A betegek és a HC 16S rRNS gén kópiaszámai közötti különbség statisztikailag nem volt szignifikáns (P ≥ 0,05). A bft gén kópiaszáma több volt a betegek mintáiban, mint az egészséges kontrollokéban (P = 0,00). Továbbá, a bft gén kópiaszáma több volt az ETBF pozitív mintákban a prekurzor léziók csoportjában, mint a CRC-ben szenvedőkben; ez a különbség azonban statisztikailag nem volt szignifikáns. A szekvenálási eredmények megerősítették a bft és a 16S rRNS gének jelenlétét (1. adatlap).
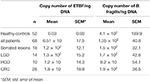
4. táblázat. A 16S rRNS-gén és a bft-gének kvantitatív elemzése klinikopatológiai csoportokban és HC-ben.
Az e minták eredményei továbbá azt mutatták, hogy a bft-gén legelterjedtebb altípusa a bft1, amelyet a bft2 követ. A 32 bft-gént hordozó izolátumból 18 (56,2%) izolátum bft-1 és 14 (43,7%) izolátum bft-2 altípusúnak bizonyult. Ezenkívül a bft-gént a HC-minták közül 2 mintában mutatták ki, és mindegyikük bft-1 altípusú volt. Egyetlen DNS-minta sem hordozta a bft-3 altípust.
Diszkusszió
Egyre több bizonyíték van a mikrobiális diszbiózis hatására a bélben, a kolorektális rák beindulására és kialakulására (Sears és Garrett, 2014; Gagniere és mtsai., 2016). Bár a CRC előfordulását Iránban más országokhoz képest alacsonyabbnak jelentették, a jövőben várhatóan növekedni fog (Hosseini et al., 2004; Malekzadeh et al., 2009). Korábbi tanulmányokban arról is beszámoltak, hogy az ETBF-nek szerepe lehet a hasmenésben és az IBD-ben (Myers et al., 1987; Prindiville et al., 2000; Basset et al., 2004; Merino et al., 2011; Purcell et al., 2017; Zamani et al, 2017).
Egyes vizsgálatok szerint bizonyos baktériumfajok (pl. ETBF) patogén baktériumokként működhetnek, amelyek tisztázzák a bél mikrobiális közösségében kialakuló diszbiózist és kiváltják a CRC-t (Hajishengallis és mtsai., 2012; Hajishengallis és Lamont, 2016). A kolorektális tumorigenezist a BFT okozta immunválaszok és a proinflammatorikus citokinek aktiválódása indukálta (Wu és mtsai., 2004, 2009).
A vizsgálat eredményei azt mutatták, hogy az ETBF szignifikánsan társult a serrated elváltozásokhoz, amelyeket LGD követett. A magasabb esélyhányados ezeknél az elváltozásoknál azt is mutatta, hogy az ETBF-expozíció a rákos és különösen a rák előtti állapotok kockázati tényezője. Ez alátámasztja azt a hipotézist, hogy a BFT-t termelő törzsek fontos szerepet játszhatnak a gyulladás és az immunológiai válasz kiváltásában a genetikailag fogékony személyeknél, és CRC-hez vezethetnek. Az első tanulmányt, amely az ETBF fokozott előfordulását bizonyította a vastagbélrákos betegek székletmintáiban (38%) a kontrollcsoporthoz (12%) képest, Ulger Toprak és munkatársai (2006) végezték. Ezenkívül néhány korábbi jelentés összefüggést mutatott ki a bft gén és a CRC között, különösen a CRC késői stádiumában (Dejea et al., 2014; Boleij et al., 2015; Viljoen et al., 2015). A Purcell és munkatársai által végzett vizsgálat az ETBF szignifikáns társulását mutatta ki a tubuláris adenómákkal, a serrated elváltozásokkal és az alacsony fokú diszpláziával, ami hasonló volt a jelen vizsgálat eredményeihez (Purcell és munkatársai, 2017).
A jelen vizsgálatban a prekurzor elváltozások, beleértve az alacsony fokú diszpláziával rendelkezőket is, növekvő tendenciát mutattak a bft gén mennyiségében a CRC-vel rendelkezőkhöz képest; ez a különbség azonban statisztikailag nem volt szignifikáns. Továbbá a szerzők korábban már beszámoltak arról, hogy a CRC-re hajlamos, fekélyes vastagbélgyulladásos betegek vastagbelében és terminális ileumában ETBF markereket figyeltek meg (Zamani és mtsai., 2017; Rashidan és mtsai., 2018). Hasonlóképpen, egy korábbi vizsgálatban ennek a génnek csak a bft1 altípusát mutatták ki (Zamani és mtsai., 2017). Bár a bft1 gén volt a legelterjedtebb altípus, ebben a vizsgálatban a bft2 gén is megtalálható volt.
Ebben a vizsgálatban az ETBF-et kimutatták a CRC-betegek lézióiban, és hasonló eredményekről számoltak be korábban más kutatók is, akik vastagbélnyálkahártya-mintákban vizsgálták az ETBF-et (Boleij et al., 2015; Viljoen et al., 2015). A bélmikrobiom szerepével foglalkozó legújabb tanulmányok kimutatták, hogy a CRC-betegek nem tumoros és tumoros régióiban a mikrobiális közösségben diszbiózis lép fel (Dejea és mtsai., 2014; Flemer és mtsai., 2017; Purcell és mtsai., 2017). Ezekben a vizsgálatokban kimutatták, hogy egyes baktériumok, köztük a Fusobacterium nucleatum, ETBF, Escherichia coli, Streptococcus gallolyticus és Enterococcus faecalis, valamint a butiráttermelő baktériumok fontos szerepet játszhatnak a CRC kialakulásában (Dejea et al, 2014; Flemer et al., 2017; Park et al., 2018).
A B. fragilis kimutatására szolgáló valós idejű PCR eredményei azt mutatták, hogy a betegek és a HC több százaléka tartalmazott B. fragilist a tenyésztési módszerhez képest. A baktériumok kimutatásának arany standard módszere a tenyésztésen alapuló módszer, de nagyszámú életképes sejtet igényel, és kifejezetten az anaerob baktériumtenyészet esetében bizonyos korlátok előfordulhatnak. Lehet, hogy ezek a korlátozások befolyásolják az eredmények közötti különbséget.
A B. fragilis kultúrák és a Real-time PCR eredmények közötti különbségek a kontrollok és a CRC minták között nem szignifikánsak. Ezek az adatok arra utalnak, hogy valószínűleg a bft-gént hordozó törzsek, és nem a B. fragilis önmagában járulhatott hozzá a CRC kialakulásához ebben a vizsgálatban. Kimutatták, hogy a B. fragilis kiemelkedő humán komensál, így ez a baktérium a betegekhez hasonlóan egészséges kontrollokból is izolálható. A rákos és rákot megelőző elváltozásokban szenvedő betegeknél azonban a bft-géneket tartalmazó törzsek egy része megnövekedett, és ez a diszbiózis valószínűleg gyulladást idézhet elő. Emellett egyes tanulmányok kimutatták, hogy a humán komensális B. fragilis megakadályozta a vastagbélgyulladás kialakulását, és hatékony terápiás stratégiát jelenthet a CRC kezelésére, míg különböző tanulmányok szerint e baktérium enterotoxigén törzsei az enterotoxin-termelés miatt béldaganatokkal hozhatók összefüggésbe (Sears et al., 1995, 2014; Mazmanian et al., 2008; Lee et al., 2018).
A vizsgálatnak volt néhány korlátozása. Különböző módszereket alkalmaztak a bft gén diagnosztizálására, amelyet közvetlenül a betegek vastagbelében lévő tumorszövetekből vontak ki. Így egy nagy populációs alapú kohorszvizsgálat elvégzése erősen ajánlott. Ezenkívül további vizsgálatokra van szükség a bft gén jelenléte és a serrated léziók, az LGD és a CRC közötti esetleges összefüggés bizonyítására.
Következtetések
A tanulmány eredményei arra utalnak, hogy az ETBF jelen lehet a CRC-s betegek mellett a rákot megelőző állapotokban, például serrated léziókban és LGD-ben szenvedő betegek nyálkahártya-biopsziáiban is. Szignifikáns összefüggést találtunk az ETBF jelenléte az érintett szövetekben és e baktériumok száma között a betegek mintáiban, különösen a rákot megelőző karcinogén elváltozásokban: az alacsony fokú diszpláziával járó adenomákban és a serrated elváltozásokban. Valójában az ETBF gyakrabban mutatható ki a korai elváltozásokban, de a további, nagyobb számú mintával végzett kutatások hasznosnak tűntek a pontos meghatározáshoz.
Akár további kutatásokra van szükség annak megállapítására, hogy az életkor, a nem, az étrend és más környezeti tényezők befolyásolják-e az ETBF diagnózisát az emberekben az idők folyamán.
Végeredményben az ETBF a CRC prognózisának markere lehet, különösen a rákot megelőző elváltozásokban, és felhasználható lenne ezen betegségek szűrésére.
Adatok hozzáférhetőségi nyilatkozata
A kézirat következtetéseit alátámasztó nyers adatokat a szerzők indokolatlan fenntartás nélkül bármely szakképzett kutató rendelkezésére bocsátják.
Etikai nyilatkozat
A humán résztvevőkkel végzett vizsgálatokat a Teheráni Orvostudományi Egyetem Etikai Bizottsága felülvizsgálta és jóváhagyta. A betegek/résztvevők írásbeli beleegyezésüket adták a vizsgálatban való részvételhez.
A szerzők hozzájárulása
SZ az első szerző, aki az összes laboratóriumi kísérletet elvégezte, az adatokat összegyűjtötte és elemezte, valamint a kéziratot megszerkesztette. RT a gasztroenterológus, aki kolonoszkópiát végzett és biztosította a mintákat minden esetből. LS részt vett a vizsgálat tervezésében és koordinálásában, és tanácsot adott a vizsgálat minden részében. AS és SJ részt vett a minták gyűjtésében és a vizsgálatok elvégzésében. MF felügyelte a vizsgálat minden részét. Minden szerző elolvasta és jóváhagyta a kéziratot.
Finanszírozás
Ezt a munkát a Teheráni Orvostudományi Egyetem támogatta (Grant No: 32467).
Érdekütközés
A szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális érdekellentétként értelmezhetők.
Köszönet
A szerzők köszönetet mondanak az Imam Khomeini kórház személyzetének a minták gyűjtésében nyújtott szíves támogatásukért.
Kiegészítő anyag
A cikkhez tartozó kiegészítő anyag online elérhető a következő címen: https://www.frontiersin.org/articles/10.3389/fcimb.2019.00449/full#supplementary-material
Adatlap 1. A bft és 16S rRNS gének szekvenálási eredményei egy izolátumban.
Basset, C., Holton, J., Bazeos, A., Vaira, D., and Bloom, S. (2004). A Helicobacter fajok és az enterotoxigén Bacteroides fragilis részt vesznek az in?szakmai bélbetegségben? Dig. Dis. Sci. 49, 1425-1432. doi: 10.1023/B:DDAS.0000042241.13489.88
CrossRef Full Text | Google Scholar
Boleij, A., Hechenbleikner, E. M., Goodwin, A. C., Badani, R., Stein, E. M., Lazarev, M. G., et al. (2015). A Bacteroides fragilis toxin génje elterjedt a vastagbélrákos betegek vastagbélnyálkahártyájában. Clin. Infect. Dis. 60, 208-215. doi: 10.1093/cid/ciu787
PubMed Abstract | CrossRef Full Text | Google Scholar
Boyle, P., and Langman, J. (2000). A vastagbélrák ABC-je: epidemiológia. BMJ 321, 805-808. doi: 10.1136/bmj.321.7264.805
PubMed Abstract | CrossRef Full Text | Google Scholar
Dejea, C. M., Wick, E. C., Hechenbleikner, E. M., White, J. R., Mark Welch, J. L., Rossetti, B. J., et al. (2014). A mikrobióta szerveződése a proximális vastagbélrákok sajátos jellemzője. Proc. Natl. Acad. Sci. U.S.A. 111, 18321-18326. doi: 10.1073/pnas.1406199111
PubMed Abstract | CrossRef Full Text | Google Scholar
Ferlay, J., Soerjomataram, I., Dikshit, R., Eser, S., Mathers, C., Rebelo, M., et al. (2015). Rákos megbetegedések és halálozás világszerte: források, módszerek és főbb minták a GLOBOCAN 2012-ben. Int. J. Cancer 136, E359-E386. doi: 10.1002/ijc.29210
PubMed Abstract | CrossRef Full Text | Google Scholar
Flemer, B., Lynch, D. B., Brown, J. M., Jeffery, I. B., Ryan, F. J., Claesson, M. J., et al. (2017). Tumorasszociált és nem tumorasszociált mikrobióta vastagbélrákban. Gut 66, 633-643. doi: 10.1136/gutjnl-2015-309595
PubMed Abstract | CrossRef Full Text | Google Scholar
Gagniere, J., Raisch, J., Veziant, J., Barnich, N., Bonnet, R., Buc, E., et al. (2016). A bél mikrobióta egyensúlytalansága és a vastagbélrák. World J. Gastroenterol. 22, 501-518. doi: 10.3748/wjg.v22.i2.501
PubMed Abstract | CrossRef Full Text | Google Scholar
Hajishengallis, G., Darveau, R. P., and Curtis, M. A. (2012). A kulcskő-patogén hipotézis. Nat. Rev. Microbiol. 10, 717-725. doi: 10.1038/nrmicro2873
PubMed Abstract | CrossRef Full Text | Google Scholar
Hajishengallis, G., and Lamont, R. J. (2016). Tánc a csillagokkal: hogyan diktálják a koreografált bakteriális kölcsönhatások a nososzimbiocitást, és hogyan keletkeznek a kulcspont-kórokozók, a járulékos kórokozók és a patobionták. Trends Microbiol. 24, 477-489. doi: 10.1016/j.tim.2016.02.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Hosseini, S. V., Izadpanah, A., and Yarmohammadi, H. (2004). A vastagbélrák epidemiológiai változásai az iráni Shirazban: 1980-2000. ANZ J. Surg. 74, 547-549. doi: 10.1111/j.1445-2197.2004.03064.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Johnson, C. M., Wei, C., Ensor, J. E., Smolenski, D. J., Amos, C. I., Levin, B., et al. (2013). A vastagbélrák kockázati tényezőinek metaanalízisei. Cancer Causes Control. 24:120722. doi: 10.1007/s10552-013-0201-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Kolahdoozan, S., Sadjadi, A., Radmard, A. R., and Khademi, H. (2010). Öt gyakori rákos megbetegedés Iránban. Arch. Iran Med. 13, 143-146.
PubMed Abstract | Google Scholar
Lee, Y. K., Mehrabian, P., Boyajian, S., Wu, W. L., Selicha, J., Vonderfecht, S., et al. (2018). A bacteroides fragilis védő szerepe a vastagbélrákkal összefüggő vastagbélrák egérmodelljében. mSphere. 3:e00587-e00518. doi: 10.1128/mSphere.00587-18
PubMed Abstract | CrossRef Full Text | Google Scholar
Malekzadeh, R., Bishehsari, F., Mahdavinia, M., and Ansari, R. (2009). A vastagbélrák epidemiológiája és molekuláris genetikája Iránban: áttekintés. Arch. Iran Med. 12:161-169.
PubMed Abstract | Google Scholar
Mazmanian, S. K., Round, J. L., and Kasper, D. L. (2008). Egy mikrobiális szimbiózis faktor megelőzi a bélrendszeri gyulladásos betegségeket. Nature. 453, 620-625. doi: 10.1038/nature07008
PubMed Abstract | CrossRef Full Text | Google Scholar
Merino, V. R., Nakano, V., Liu, C., Song, Y., Finegold, S. M., and Avila-Campos, M. J. (2011). Hasmenéses és hasmenés nélküli gyermekekből izolált enterotoxikus Bacteroides fragilis altípusok mennyiségi kimutatása. J. Clin. Microbiol. 49, 416-418. doi: 10.1128/JCM.01556-10
PubMed Abstract | CrossRef Full Text | Google Scholar
Moghimi-Dehkordi, B., Safaee, A., and Zali, M. (2008). Prognosztikai tényezők 1138 iráni vastagbélrákos betegnél. Int. J. Colorect. Dis. 23, 683-688. doi: 10.1007/s00384-008-0463-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Myers, L. L., Shoop, D. S., Stackhouse, L. L., Newman, F. S., Flaherty, R. J., Letson, G. W., et al. (1987). Enterotoxigén Bacteroides fragilis izolálása hasmenéses emberből. J. Clin. Microbiol. 25, 2230-2233.
Google Scholar
Park, C. H., Eun, C. S., and Han, D. S. (2018). Bélmikrobióta, krónikus gyulladás és vastagbélrák. Intest. Res. 16:338. doi: 10.5217/ir.2018.16.3.338
PubMed Abstract | CrossRef Full Text | Google Scholar
Prindiville, T., Sheikh, R., Cohen, S., Tang, Y., Cantrell, M., and Silva, J. (2000). Bacteroides fragilis enterotoxin génszekvenciák in?szakmai bélbetegségben szenvedő betegeknél. Emerg. Infect. Dis. 6, 171-174. doi: 10.3201/eid0602.000210
CrossRef Full Text | Google Scholar
Purcell, R. V., Pearson, J., Aitchison, A., Dixon, L., Frizelle, F. A., and Keenan, J. I. (2017). Az enterotoxigén Bacteroides fragilis-szel való kolonizáció összefügg a korai stádiumú kolorektális neopláziával. PLoS ONE 12:e0171602. doi: 10.1371/journal.pone.0171602
PubMed Abstract | CrossRef Full Text | Google Scholar
Rafiemanesh, H., Pakzad, R., Abedi, M., Kor, Y., Moludi, J., Towhidi, F., et al. (2016). Vastagbélrák Iránban: epidemiológiai és morfológiai trendek. EXCLI J. 15, 738-744. doi: 10.17179/2Fexcli2016-346
PubMed Abstract | CrossRef Full Text | Google Scholar
Rashidan, M., Azimirad, M., Alebouyeh, M., Ghobakhlou, M., Aghdaei, H. A., and Zali, M. R. (2018). A B. fragilis csoport kimutatása és a bft enterotoxin és a cepA, cfiA és nim antibiotikum-rezisztencia markerek diverzitása a gyulladásos bélbetegségben szenvedő betegek bélrendszeri Bacteroides fragilis törzsei között. Anaerobe 50, 93-100. doi: 10.1016/j.anaerobe.2018.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Sears, C. L., and Garrett, W. S. (2014). Mikrobák, mikrobióta és vastagbélrák. Cell Host Microbe 15, 317-328. doi: 10.1016/j.chom.2014.02.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Sears, C. L., Geis, A. L., and Housseau, F. (2014). A Bacteroides fragilis felforgatja a nyálkahártya biológiáját: a szimbiontától a vastagbél karcinogeneziséig. J. Clin. Invest. 124, 4166-4172. doi: 10.1172/JCI72334
PubMed Abstract | CrossRef Full Text | Google Scholar
Sears, C. L., Myers, L. L., Lozenby, A., and Van Tassel, R. L. (1995). Enterotoxigén Bacteroides fragilis. Clin Infect Dis. 20(suppl):142-148. doi: 10.1093/clinids/20.Supplement_2.S142
CrossRef Full Text | Google Scholar
Siegel, R., DeSantis, C., and Jemal, A. (2014). A vastagbélrák statisztikái, 2014. Cancer J. Clinic. 64, 104-117. doi: 10.3322/caac.21220
PubMed Abstract | CrossRef Full Text | Google Scholar
Swiderska, M., Choromanska, B., Dabrowska, E., Konarzewska-Duchnowska, E., Choromanska, K., Szczurko, G., et al. (2014). A vastagbélrák diagnosztikája. Contempor Oncol. 18, 1-6. doi: 10.5114/wo.2013.39995
PubMed Abstract | CrossRef Full Text | Google Scholar
Ulger Toprak, N., Yagci, A., Gulluoglu, B. M., Akin, M. L., Demirkalem, P., Celenk, T., et al. (2006). A Bacteroides fragilis enterotoxin lehetséges szerepe a vastagbélrák etiológiájában. Clin. Microbiol. Infect. 12, 782-786. doi: 10.1111/j.1469-0691.2006.01494.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Viljoen, K. S., Dakshinamurthy, A., Goldberg, P., and Blackburn, J. M. (2015). A vastagbélrákhoz társuló baktériumok kvantitatív profilalkotása összefüggéseket tár fel a Fusobacterium spp. és az enterotoxigén Bacteroides fragilis (ETBF), valamint a vastagbélrák klinikopatológiai jellemzői között. PLoS ONE 10:e0119462. doi: 10.1371/journal.pone.0119462
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, S., Lim, K. C., Huang, J., Saidi, R. F., and Sears, C. L. (1998). A Bacteroides fragilis enterotoxin hasítja a zonula adherens fehérjét, az E-cadherint. Proc. Natl. Acad. Sci. U.S.A. 95, 14979-14984. doi: 10.1073/pnas.95.25.14979
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, S., Morin, P. J., Mauyo, D. J. I. K., and Sears, C. (2003). A Bacteroides fragilis enterotoxin indukálja a c-myc expressziót és a sejtproliferációt. Gastroenterology 124, 392-400. doi: 10.1053/gast.2003.50047
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, S., Powell, J., Mathioudakis, N., Kane, S., Fernandez, E., and Sears, C. L. (2004). A Bacteroides fragilis enterotoxin mitogén-aktivált protein kinázokon és egy tirozinkináz-szabályozott nukleáris faktor-kappaB útvonalon keresztül indukálja az interleukin-8 bélhámsejtek szekrécióját. Infect. Immun. 72, 5832-5839. doi: 10.1128/IAI.72.10.5832-5839.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, S., Rhee, K. J., Albesiano, E., Rabizadeh, S., Wu, X., Yen, H. R., et al. (2009). Egy humán vastagbél komensál elősegíti a vastagbél tumorigenezist a 17-es típusú T helper T-sejt válaszok aktiválásán keresztül. Nat. Med. 15, 1016-1022. doi: 10.1038/nm.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Zamani, S., Shariati, S. H., Zali, M. R., Aghdaei, H. A., Asiabar, A. S., Bokaie, S., et al. (2017). Enterotoxigén Bacteroides fragilis kimutatása fekélyes vastagbélgyulladásban szenvedő betegeknél. Gut Pathogens 9:53. doi: 10.1186/s13099-017-0202-0
PubMed Abstract | CrossRef Full Text | Google Scholar