Frontiers in Cellularand Infection Microbiology
- Introducere
- Materiale și metode
- Pacienți și probe
- Cultura bacteriană
- Extracția ADN-ului
- Real-Time PCR
- Analiză statistică
- Rezultate
- Discuție
- Concluzii
- Declarație privind disponibilitatea datelor
- Declarație etică
- Contribuții ale autorilor
- Finanțare
- Conflict de interese
- Recunoștințe
- Material suplimentar
- Supplementary Material
- Subtitlu de material suplimentar
Introducere
Bacteroides fragilis, care se găsește în flora gastrointestinală a oamenilor și a animalelor, este o bacterie anaerobă. Este unul dintre comensalii umani proeminenți și unul dintre cei mai comuni Bacteroides izolați din probele clinice, care provoacă diaree, peritonită, abcese intraabdominale, septicemie și infecții purulente endogene (Sears et al…, 1995, 2014).
S-a demonstrat că B. fragilis previne bolile inflamatorii intestinale la animalele cu colită datorită producerii moleculei imunomodulatoare polizaharida A (PSA) care induce un răspuns imunitar antiinflamator în țesutul intestinal (Mazmanian et al., 2008; Lee et al., 2018). Patogenitatea lui B. fragilis se datorează mai multor factori, inclusiv capsulei, proteinelor din membrana externă (OMP) și enzimelor speciale care cuprind o metaloprotează de 20 kDa denumită toxina Bacteroides fragilis (BFT) (Sears et al., 1995, 2014).
B. fragilis producătoare de BFT, B. fragilis enterotoxigenă (ETBF), a fost cunoscută ca fiind o cauză a tulburărilor diareice la oameni și animale (Myers et al., 1987; Purcell et al., 2017). ETBF este cunoscut ca fiind un factor de risc pentru boala inflamatorie intestinală (IBD) și este prezent în materiile fecale și în probele de biopsie ale pacienților (Prindiville et al., 2000; Basset et al., 2004; Zamani et al., 2017). Expresia BFT se dovedește a cliva domeniul extracelular al E-cadherinei, care este un constituent structural major al zonulei adherens și este responsabil pentru aderența celulară. Mai mult, BFT poate activa semnalizarea B-catenin și poate induce secreția IL8 în celulele epiteliale colonice (Wu et al., 1998). Un studiu a indicat că, în urma tratamentului cu BFT al celulelor HT29/C1, pierderea E-cadherinei asociate membranei a inițiat localizarea nucleară a ß-cateninei, care a indus traducerea c-myc și a condus la o proliferare celulară persistentă (Wu et al., 2003). Puterea BFT și influența sa asupra structurii și fiziologiei epiteliale gastrointestinale sugerează că prezența ETBF poate contribui la bolile cronice ale colonului, inclusiv la transformarea oncogenă, inflamația intestinală, disfuncțiile cronice ale colonului și leziunile precanceroase și canceroase colorectale (Wu et al., 1998, 2003; Sears et al., 2014).
Cancerul colorectal (CCR) este unul dintre cele mai răspândite cancere la nivel mondial și cuprinde 9 % din toate cancerele și este a patra cauză a deceselor legate de cancer la nivel mondial (Sears et al., 1995; Ferlay et al., 2015). Cu toate acestea, există o diferență semnificativă între țări în ceea ce privește incidența standardizată pe vârstă a acestui cancer; rata de incidență în SUA și în țările europene este de peste 25 de ori mai mare decât cea din țările africane și asiatice. Rata de morbiditate și mortalitate a CCR s-a redus în ultimii ani datorită testelor de screening îmbunătățite care pot detecta modificările colorectale în stadii mai timpurii și a îmbunătățirii medicației și procedurilor (Boyle și Langman, 2000; Rafiemanesh et al, 2016).
CRC este unul dintre cele mai frecvente tipuri de cancer în Iran și este al treilea cel mai frecvent cancer în rândul bărbaților iranieni (8,1-8,3 la 100.000 de locuitori) și al patrulea cel mai răspândit cancer în rândul femeilor iraniene (6,5-7,5 la 100.000 de locuitori) (Moghimi-Dehkordi et al., 2008; Kolahdoozan et al., 2010). Factorii de risc ai CCR sunt obezitatea, stilul de viață sedentar, dieta bogată în grăsimi, dieta săracă în legume și fructe, fumatul, abuzul de alcool și medicamentele antiinflamatoare nesteroidiene (AINS). Inflamația cronică, IBD, polipii, adenomul și displazia cauzează modificări ale celulelor colonului și le fac predispuse la cancer (Boyle și Langman, 2000; Johnson et al., 2013).
Incidența și mortalitatea CCR este în scădere în națiunile occidentale dezvoltate, în timp ce incidența sa este în creștere în rândul ambelor sexe în ultimele decenii în Iran, din cauza modificărilor stilului de viață și a alimentației. Un alt motiv pentru această scădere poate fi creșterea numărului de facilități și îmbunătățirea echipamentelor și tehnologiei, deoarece tot mai multe persoane se adresează unităților de sănătate pentru screening, în timp ce în trecut, o persoană ar fi putut avea un cancer și chiar să fi murit, dar cancerul a rămas nediagnosticat din cauza lipsei de echipamente și facilități (Malekzadeh și colab., 2009; Siegel și colab, 2014).
În acest studiu, frecvența și abundența ETBF în probele de biopsie ale pacienților cu CCR și afecțiuni precanceroase au fost comparate cu cele ale persoanelor fără antecedente personale sau familiale de boală colorectală pentru a investiga asocierea dintre prezența ETBF și dezvoltarea tumorii.
Materiale și metode
Pacienți și probe
În acest studiu de control de caz, 120 de biopsii de mucoasă au fost colectate de la pacienți iranieni cu afecțiuni precanceroase și CCR (n = 68) și din grupul de control (n = 52) prin colonoscopie. Pacienții cu leziuni precanceroase (leziunile zimțate, adenomul includ displazia de grad scăzut: LGD și displazie de grad înalt: HGD) și afecțiuni canceroase (cancer colorectal: CCR) care au fost trimiși la spitalul Imam Khomeini din Teheran între martie 2015 și ianuarie 2017 au fost selectați pentru a participa la acest studiu. Comitetul de etică al Universității de Științe Medicale din Teheran a aprobat protocolul de studiu. De asemenea, consimțământul informat a fost obținut de la toți participanții. Toți pacienții au fost diagnosticați pe baza simptomelor clinice, precum și a standardelor histologice și radiografice, care au prezentat caracteristici tipice cu distribuție specială (Swiderska et al., 2014). Toate datele privind vârsta, sexul și tipul de leziuni au fost preluate din dosarele pacienților. Toți pacienții care intră în studiu au fost diagnosticați în momentul colonoscopiei, iar chimioterapia nu a început pentru tratarea lor.
În aceeași perioadă, 52 de controale sănătoase, fără antecedente personale sau familiale de boală colorectală diagnosticată, a căror vârstă și sex s-au potrivit cu cele ale pacienților, au fost incluse în studiu ca și controale. Un istoric recent de diaree și IBD a fost un criteriu de excludere pentru controale. Niciuna dintre persoanele care au luat parte la acest studiu nu a utilizat antibiotice sau probiotice în ultimele 3 luni. Toate probele au fost păstrate în recipient steril care cuprinde mediu tioglicolat (Merck, Germania) și au fost transportate la laborator în condiții anaerobe pentru a fi manipulate imediat. De asemenea, au fost prelevate 2 biopsii de mucoasă de la fiecare pacient pentru cultură și extracție de ADN.
Cultura bacteriană
Două omogenizatoare de sticlă au fost utilizate pentru întreruperea mecanică și omogenizarea tuturor biopsiilor; apoi, acestea au fost cultivate pe mediul Bacteroides Bile Esculin agar (BBE) (Himedia Laboratories Pvt. Ltd, India). În acest studiu, sistemul Anoxomat (MART Microbiology Drachten, Țările de Jos) a fost utilizat pentru a asigura condiții atmosferice gazoase pentru anaerobi; apoi, plăcile au fost incubate într-o cameră anaerobă la 37°C timp de 72 h. În plus, B. fragilis a fost confirmat prin metoda PCR în timp real.
Extracția ADN-ului
Ana a fost extrasă direct din țesutul biopsiei cu ajutorul kitului RTP® Mycobacteria Kit (Invitek, Berlin, Germania). Densitatea optică (OD) a ADN-ului extras a fost determinată la 260 nanometri. Apoi, ADN-ul a fost conservat la -20°C pentru analize ulterioare și PCR în timp real.
Real-Time PCR
Secvențele genei bft și 16S rRNA au fost recuperate din Banca de gene. Amorsele și sondele au fost proiectate cu ajutorul primerului 3 plus (http://www.bioinformatics.nl/cgi-bin/primer3plus/primer3plus.cgi). Toți primerii și sondele utilizate pentru detectarea tuturor tipurilor de gene bft au fost proiectate în studiul nostru anterior (Zamani et al., 2017). Pentru a detecta subtipurile genei bft, PCR în timp real a fost efectuată așa cum a fost descrisă anterior (Merino et al., 2011).
DNA genomic al tulpinii ETBF D-134 și al clonei RIGLD 1 au fost utilizate ca martori pozitivi (Rashidan et al., 2018). Controlul negativ a fost PCR TaqMan master mix cu apă distilată în loc de ADN.
Andemnul standard a fost preparat pentru amplificare și numărul de molecule de șablon pe gram a fost calculat prin formula definită (Zamani et al., 2017). Curba standard pentru bft și gena ARNr 16S a fost evaluată folosind fiecare amorsă și sondă cu o diluție în serie de 10 ori a probelor de ADN de B. fragilis, ceea ce corespunde unei valori medii de 101-106 pe gram de biopsii.
În conformitate cu curba standard și y-interceptul, probele care nu au prezentat semnalul fluorescent mai devreme de Ct de 38 au fost determinate ca fiind negative. De asemenea, probele care au produs fluorescență cu o valoare Ct ≤ 10 au fost diluate. Eficacitatea PCR în timp real a fost determinată ca E = 10(-1/slop) – 1 (Zamani et al., 2017).
După optimizarea curbelor standard, seria de diluție a fost pusă în fiecare serie de amplificare. Testele PCR în timp real au fost evaluate cu ajutorul instrumentului LinGene K Real Time PCR (Bioer, Hangzhou, PR, China). Toate testele au fost efectuate într-un volum de 25 μL (Zamani et al., 2017). Pentru a asigura calitatea, toate experimentele au fost repetate pentru a doua oară în mod independent, iar mediile au fost raportate.
Pentru a verifica specificitatea PCR și dimensiunea așteptată a produsului, amperii au fost aplicați într-o PCR convențională, iar ampliconii au fost analizați pe gel de agaroză. Mai mult, specificitatea fragmentelor pozitive amplificate a fost dovedită prin secvențiere. Produsul PCR a fost trimis la Macrogen Corporation din Coreea de Sud pentru secvențiere. Rezultatele secvențierii au fost analizate cu software-ul Chromas 2.6. Apoi, toate secvențele au fost introduse în baza de date NCBI (https://blast.ncbi.nlm.nih.gov/Blast.cgi). La toate izolatele secvențiate, procentul de similaritate cu genele înrudite (gena ARNr 16s și gena bft) prezente în baza de date NCBI a fost mai mare de 95%.
Analiză statistică
Rezultatele au fost comparate cu ajutorul testelor Fisher’s Exact, Chi pătrat și Mann-Whitney. P < 0,05 a fost considerat ca fiind semnificativ din punct de vedere statistic. De asemenea, au fost calculate valorile medii ± eroarea standard a mediei (SEM) pentru B. fragilis și ETBF. Datele au fost analizate cu ajutorul software-ului statistic SPSS 13.0.
În acest studiu, regresia logistică condiționată a fost utilizată pentru a evalua rapoartele de probabilitate (OR) și intervalele de încredere de 95%. În acest model, raportul de probabilitate este un estimator consistent al raportului ratei de CCR atunci când sunt expuși cu ETBF față de subiecții neexpuși.
Rezultate
În acest studiu, 68 de probe au fost colectate de la pacienții cu CCR (36 bărbați și 32 de femei; vârsta medie: 55 de ani; interval: 35-78) și 52 de probe au fost prelevate de la controale sănătoase (HC) (30 de bărbați și 22 de femei; vârsta medie: 56 de ani; interval: 42-78). Toți pacienții au fost diagnosticați pe baza procedurilor de colonoscopie la momentul prelevării de probe. Toți pacienții diagnosticați la momentul colonoscopiei, ceea ce dă un total de 26 de pacienți cu CCR invaziv, 18 de pacienți cu leziuni zimțate, 24 de pacienți cu adenom includ 14 pacienți cu LGD și 10 pacienți cu HGD conform clasificării actuale (figura 1). Aceste biopsii au fost recoltate de pe partea dreaptă (ascendentă), de pe partea stângă (descendentă) și de pe ambele părți la 22, 32 și, respectiv, 14 pacienți (Tabelul 1).
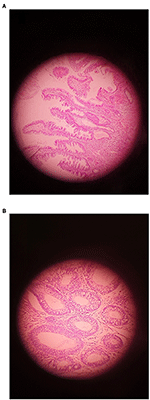
Figura 1. Un exemplu de adenom care prezintă (A) LGD și (B) HGD (mărire originală ×400).
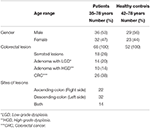
Tabel 1. Caracteristicile pacienților și ale HC.
Rezultatele pentru cultura de B. fragilis au fost pozitive pentru 31(51%) și 25 (48%) de probe ale pacienților și, respectiv, ale controalelor sănătoase (tabelul 2) (P = 0,7).

Tabel 2. Date privind cultura de Bacteroides fragilis.
Conform curbei standard, diluțiile de ADN ETBF (control pozitiv) la 101, 102, 103, 104, 105 și 106 au furnizat valori Ct de 15,08 ± 0,1, 18,04 ± 0,2, 21,42 ± 0,2, 25,02 ± 0,2, 28,02 ± 0,4 și, respectiv, 31,96 ± 0,4. Eficiența PCR în timp real a fost între 98 și 100%.
Eșantioanele pozitive pentru gena ARNr 16S și gena bft au fost de 63 și 47% la pacienți. Cu toate acestea, rezultatele pozitive au fost prezentate în 81 și, respectiv, 3,8% din probele HC (tabelul 3). Diferența dintre pozitivitatea genei bft la pacienți și HC a fost semnificativă din punct de vedere statistic (P = 0,00).
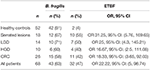
Tabel 3. Numărul de eșantioane pozitive pentru gena ARNr 16S și genele bft în grupurile clinicopatologice și HC.
De asemenea, numărul de eșantioane pozitive pentru genele bft în CCR și HC în cadrul grupurilor clinicopatologice este prezentat în tabelul 3. Cel mai mare OR a fost găsit în grupul leziunilor zimțate, urmat de grupul leziunilor adenomatoase cu LGD. De asemenea, OR pentru toți pacienții (OR 22,22, 95% CI: 5, 98,74) a descris asocierea dintre ETBF și existența leziunilor.
Rezultatele analizei cantitative a PCR în timp real pentru gena 16S ARNr numărată pentru B. fragilis și gena bft numărată pentru ETBF pe ng ADN au fost prezentate în tabelul 4. Diferența dintre numărul de copii ale genei 16S ARNr la pacienți și HC nu a fost semnificativă din punct de vedere statistic (P ≥ 0,05). Numărul de copii ale genei bft a fost mai mare în probele pacienților decât în cele ale controalelor sănătoase (P = 0,00). Mai mult, numărul de copii ale genei bft a fost mai mare în probele ETBF pozitive din grupul leziunilor precursoare în comparație cu cele cu CCR; cu toate acestea, această diferență nu a fost semnificativă din punct de vedere statistic. Rezultatele secvențierii au confirmat prezența genelor bft și ARNr 16S (Fișa de date 1).
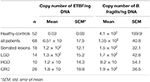
Tabel 4. Analiza cantitativă a genei ARNr 16S și a genelor bft în grupurile clinico-patologice și HC.
Mai mult, rezultatele acestor probe au indicat că cel mai răspândit subtip al genei bft a fost bft1, urmat de bft2. Din cele 32 de izolate care adăpostesc gena bft, 18 (56,2%) izolate au fost subtipate ca bft-1 și 14 (43,7%) izolate au fost subtipate ca bft-2. În plus, gena bft a fost detectată în 2 dintre probele HC, iar toate acestea au fost subtipate ca bft-1. Nicio probă de ADN nu a găzduit subtipul bft-3.
Discuție
Există tot mai multe dovezi privind efectul disbiozei microbiene în intestin, inițierea și dezvoltarea cancerului colorectal (Sears și Garrett, 2014; Gagniere et al., 2016). Deși incidența CCR a fost raportată mai mică în Iran în comparație cu alte țări, s-a anticipat că rata sa va crește în viitor (Hosseini et al., 2004; Malekzadeh et al., 2009). În studiile anterioare, s-a raportat, de asemenea, că ETBF poate avea un rol în diaree și IBD (Myers et al., 1987; Prindiville et al., 2000; Basset et al., 2004; Merino et al., 2011; Purcell et al., 2017; Zamani et al, 2017).
Câteva investigații au sugerat că anumite specii bacteriene (de exemplu, ETBF) pot funcționa ca bacterii patogene care clarifică dezvoltarea disbiozei în comunitatea microbiană a intestinului și declanșează CCR (Hajishengallis et al., 2012; Hajishengallis și Lamont, 2016). Tumorogeneza tumorală colorectală a fost indusă de răspunsurile imune și de activarea citokinelor proinflamatorii din cauza BFT (Wu et al., 2004, 2009).
Constatările acestui studiu au indicat că ETBF a fost semnificativ asociat cu leziunile zimțate urmate de LGD. Raportul de probabilitate mai mare în aceste leziuni a arătat, de asemenea, că expunerea la ETBF este un factor de risc pentru stările canceroase și mai ales precanceroase. Acest lucru susține ipoteza că tulpinile producătoare de ETBF pot avea un rol important în declanșarea inflamației și a răspunsului imunologic la persoanele susceptibile din punct de vedere genetic și pot duce la CCR. Primul studiu care demonstrează o prevalență crescută a ETBF în probele de scaun ale pacienților cu cancer colorectal (38%) în comparație cu grupul de control (12%) realizat de Ulger Toprak et al. (2006). În plus, unele rapoarte anterioare au demonstrat o asociere între gena bft și CCR, în special în stadiul tardiv al CCR (Dejea et al., 2014; Boleij et al., 2015; Viljoen et al., 2015). Un studiu efectuat de Purcell et al. a demonstrat asocieri semnificative ale ETBF cu adenoamele tubulare, leziunile zimțate și displazia de grad scăzut, care a fost similară cu rezultatele studiului de față (Purcell et al., 2017).
În acest studiu, leziunile precursoare, inclusiv cele cu displazie de grad scăzut, au prezentat o tendință de creștere a cantității genei bft în comparație cu cele cu CCR; cu toate acestea, această diferență nu a fost semnificativă din punct de vedere statistic. Mai mult, autorii au raportat anterior că markerii ETBF au fost observați în colonul și ileonul terminal al pacienților cu colită ulcerativă care sunt predispuși la CCR (Zamani et al., 2017; Rashidan et al., 2018). În mod similar, într-un studiu anterior, a fost detectat doar subtipul bft1 al acestei gene (Zamani et al., 2017). Deși gena bft1 a fost cel mai răspândit subtip, în acest studiu a fost găsită și gena bft2.
În acest studiu, ETBF a fost detectată în leziunile pacienților cu CRC, iar rezultate similare au fost raportate anterior și de alți cercetători care au studiat ETBF în probele de mucoasă colonică (Boleij et al., 2015; Viljoen et al., 2015). Studii recente privind rolul microbiomului intestinal au demonstrat că disbioza în comunitatea microbiană apare în regiunile non-tumorale și tumorale ale pacienților cu CCR (Dejea et al., 2014; Flemer et al., 2017; Purcell et al., 2017). În aceste studii s-a arătat că unele dintre bacteriile care includ Fusobacterium nucleatum, ETBF, Escherichia coli, Streptococcus gallolyticus și Enterococcus faecalis și bacteriile producătoare de butirat pot juca roluri importante în dezvoltarea CCR (Dejea et al., 2014; Flemer et al., 2017; Park et al., 2018).
Rezultatele PCR în timp real pentru detectarea B. fragilis au arătat că un procent mai mare de pacienți și HC conțineau B. fragilis în comparație cu metoda de cultură. Metoda standard de aur pentru detectarea bacteriilor este cea bazată pe cultură, dar necesită un număr mare de celule viabile și, în mod specific pentru cultura bacteriilor anaerobe, ar putea apărea unele limitări. S-ar putea ca aceste limitări să afecteze diferența dintre rezultate.
Diferențele în culturile de B. fragilis și rezultatele PCR în timp real între controalele și probele de CCR nu sunt semnificative. Aceste date sugerează că, probabil, tulpinile care adăpostesc gena bft, nu B. fragilis în sine, ar putea contribui la CCR în acest studiu. S-a demonstrat că B. fragilis este un comensal uman proeminent, astfel încât această bacterie poate fi izolată și de la controale sănătoase, ca și de la pacienți. Dar la pacienții cu leziuni canceroase și precanceroase, unele dintre tulpinile care conțin genele bft au crescut, iar această disbioză probabil poate induce inflamație. În plus, unele studii au arătat că B. fragilis comensală umană a prevenit dezvoltarea colitei și poate oferi o strategie terapeutică eficientă pentru CCR, în timp ce diverse studii sugerează că tulpinile enterotoxigene ale acestei bacterii sunt asociate cu tumorile intestinale din cauza producției de enterotoxine (Sears et al., 1995, 2014; Mazmanian et al., 2008; Lee et al., 2018).
Au existat unele limitări în acest studiu. S-au folosit diferite metode pentru a diagnostica gena bft, care a fost extrasă direct din țesuturile tumorale din colonul pacienților. Astfel, efectuarea unui studiu de cohortă de mari dimensiuni bazat pe populație este foarte recomandată. Mai mult, sunt necesare investigații suplimentare pentru a dovedi o posibilă corelație între prezența genei bft și leziunile zimțate, LGD și CCR.
Concluzii
Rezultatele acestui studiu sugerează că ETBF ar putea fi prezentă în biopsiile mucoasei pacienților cu afecțiuni precanceroase, cum ar fi leziunile zimțate și LGD, în plus față de pacienții cu CCR. S-a constatat o asociere semnificativă între prezența ETBF în țesuturile afectate și numărul acestor bacterii în probele pacienților, în special în leziunile precanceroase carcinogene: adenoame cu displazie de grad scăzut și leziuni zimțate. De fapt, ETBF este mai des detectată în leziunile precoce, dar cercetări suplimentare cu un număr mai mare de eșantioane au părut a fi utile pentru a determina cu precizie.
De asemenea, sunt necesare cercetări suplimentare pentru a determina dacă vârsta, sexul, dieta și alți factori de mediu influențează diagnosticul ETBF la om de-a lungul timpului.
În cele din urmă, ETBF ar putea fi un marker al prognosticului CCR, în special în leziunile precanceroase, și ar putea fi folosit pentru a depista aceste afecțiuni.
Declarație privind disponibilitatea datelor
Datele brute care susțin concluziile acestui manuscris vor fi puse la dispoziția oricărui cercetător calificat, fără rezerve nejustificate.
Declarație etică
Studiile care au implicat participanți umani au fost revizuite și aprobate de Comitetul de Etică al Universității de Științe Medicale din Teheran. Pacienții/participanții și-au dat consimțământul informat în scris pentru a participa la acest studiu.
Contribuții ale autorilor
SZ este primul autor care a efectuat toate experimentele de laborator, a colectat și analizat datele și a redactat manuscrisul. RT este gastroenterologul care a efectuat colonoscopia și a furnizat probele din toate cazurile. LS a participat la proiectarea și coordonarea studiului și a oferit consultanță în toate părțile studiului. AS și SJ au participat la colectarea probelor și la efectuarea testelor. MF a supervizat toate părțile studiului. Toți autorii au citit și aprobat manuscrisul.
Finanțare
Acestă lucrare a fost susținută de Universitatea de Științe Medicale din Teheran (Grant nr: 32467).
Conflict de interese
Autorii declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
Recunoștințe
Autorii doresc să mulțumească personalului spitalului Imam Khomeini pentru sprijinul lor amabil în colectarea probelor.
Material suplimentar
Materialul suplimentar pentru acest articol poate fi găsit online la adresa:
Supplementary Material
Subtitlu de material suplimentar pentru acest articol:
Subtitlu de material suplimentar
: https://www.frontiersin.org/articles/10.3389/fcimb.2019.00449/full#supplementary-material
Fila de date 1. Rezultatele secvențierii genelor bft și 16S rRNA la un izolat.
Basset, C., Holton, J., Bazeos, A., Vaira, D., și Bloom, S. (2004). Sunt speciile Helicobacter și Bacteroides fragilis enterotoxigenice implicate în boala intestinală in?ammatorie? Dig. Dis. Sci. 49, 1425-1432. doi: 10.1023/B:DDAS.0000042241.13489.88
CrossRef Full Text | Google Scholar
Boleij, A., Hechenbleikner, E. M., Goodwin, A. C., Badani, R., Stein, E. M., Lazarev, M. G., et al. (2015). Gena toxinei Bacteroides fragilis este prevalentă în mucoasa colonului la pacienții cu cancer colorectal. Clin. Infect. Dis. 60, 208-215. doi: 10.1093/cid/ciu787
PubMed Abstract | Full CrossRef Text | Google Scholar
Boyle, P., și Langman, J. (2000). ABC-ul cancerului colorectal: epidemiologie. BMJ 321, 805-808. doi: 10.1136/bmj.321.321.7264.805
PubMed Abstract | CrossRef Full Text | Google Scholar
Dejea, C. M., Wick, E. C., Wick, E. C., Hechenbleikner, E. M., White, J. R., Mark Welch, J. L., Rossetti, B. J., et al. (2014). Organizarea microbiotei este o caracteristică distinctă a cancerelor colorectale proximale. Proc. Natl. acad. Sci. U.S.A. 111, 18321-18326. doi: 10.1073/pnas.1406199111
PubMed Abstract | CrossRef Full Text | Google Scholar
Ferlay, J., Soerjomataram, I., Dikshit, R., Eser, S., Mathers, C., Rebelo, M., et al. (2015). Incidența și mortalitatea prin cancer la nivel mondial: surse, metode și modele majore în GLOBOCAN 2012. Int. J. Cancer 136, E359-E386. doi: 10.1002/ijc.29210
PubMed Abstract | CrossRef Full Text | Google Scholar
Flemer, B., Lynch, D. B., Brown, J. M., Jeffery, I. B. B., Ryan, F. J., Claesson, M. J., et al. (2017). Microbiota asociată tumorilor și neasociată tumorilor în cancerul colorectal. Gut 66, 633-643. doi: 10.1136/gutjnl-2015-309595
PubMed Abstract | Reflect Full Text | Google Scholar
Gagniere, J., Raisch, J., Veziant, J., Barnich, N., Bonnet, R., Buc, E., et al. (2016). Dezechilibrul microbiotei intestinale și cancerul colorectal. World J. Gastroenterol. 22, 501-518. doi: 10.3748/wjg.v22.i2.501
PubMed Abstract | Full CrossRef Text | Google Scholar
Hajishengallis, G., Darveau, R. P., și Curtis, M. A. (2012). The keystone-pathogen hypothesis. Nat. Rev. Microbiol. 10, 717-725. doi: 10.1038/nrmicro2873
PubMed Abstract | Full CrossRef Text | Google Scholar
Hajishengallis, G., și Lamont, R. J. (2016). Dansând cu stelele: cum interacțiunile bacteriene coregrafice dictează nososimbiozitatea și dau naștere la agenți patogeni cheie, agenți patogeni accesorii și agenți patogeni. Trends Microbiol. 24, 477-489. doi: 10.1016/j.tim.2016.02.010
PubMed Abstract | Full Text | Google Scholar
Hosseini, S. V., Izadpanah, A., și Yarmohammadi, H. (2004). Modificări epidemiologice în cancerul colorectal în Shiraz, Iran: 1980-2000. ANZ J. Surg. 74, 547-549. doi: 10.1111/j.1445-2197.2004.03064.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Johnson, C. M., Wei, C., Ensor, J. E., Smolenski, D. J. J., Amos, C. I., Levin, B., et al. (2013). Meta-analize ale factorilor de risc pentru cancerul colorectal. Cancer Causes Control. 24:120722. doi: 10.1007/s10552-013-0201-5
PubMed Abstract | Full Text | Google Scholar
Kolahdoozan, S., Sadjadi, A., Radmard, A. R., și Khademi, H. (2010). Cinci cancere comune în Iran. Arch. Iran Med. 13, 143-146.
PubMed Abstract | Google Scholar
Lee, Y. K., Mehrabian, P., Boyajian, S., Wu, W. L., Selicha, J., Vonderfecht, S., et al. (2018). Rolul protector al bacteroides fragilis într-un model murin de cancer colorectal asociat colitei. mSphere. 3:e00587-e00518. doi: 10.1128/mSphere.00587-18
PubMed Abstract | Refef Full Text | Google Scholar
Malekzadeh, R., Bishehsari, F., Mahdavinia, M., și Ansari, R. (2009). Epidemiologia și genetica moleculară a cancerului colorectal în Iran: o analiză. Arch. Iran Med. 12:161-169.
PubMed Abstract | Google Scholar
Mazmanian, S. K., Round, J. L., și Kasper, D. L. (2008). Un factor de simbioză microbiană previne boala inflamatorie intestinală. Nature. 453, 620-625. doi: 10.1038/nature07008
PubMed Abstract | Ref. Full Text | Google Scholar
Merino, V. R., Nakano, V., Liu, C., Song, Y., Finegold, S. M., și Avila-Campos, M. J. (2011). Detectarea cantitativă a subtipurilor de Bacteroides fragilis enterotoxigenice izolate de la copii cu și fără diaree. J. Clin. Microbiol. 49, 416-418. doi: 10.1128/JCM.01556-10
PubMed Abstract | Full Text | Google Scholar
Moghimi-Dehkordi, B., Safaee, A., și Zali, M. (2008). Factori prognostici la 1.138 de pacienți iranieni cu cancer colorectal. Int. J. Colorect. Dis. 23, 683-688. doi: 10.1007/s00384-008-0463-7
PubMed Abstract | Full Text | Google Scholar
Myers, L. L., Shoop, D. S., Stackhouse, L. L. L., Newman, F. S., Flaherty, R. J., Letson, G. W., et al. (1987). Izolarea de Bacteroides fragilis enterotoxigenic de la oameni cu diaree. J. Clin. Microbiol. 25, 2230-2233.
Google Scholar
Park, C. H., Eun, C. S., și Han, D. S. (2018). Microbiota intestinală, inflamația cronică și cancerul colorectal. Intest. Res. 16:338. doi: 10.5217/ir.2018.16.3.338
PubMed Abstract | CrossRef Full Text | Google Scholar
Prindiville, T., Sheikh, R., Cohen, S., Tang, Y., Cantrell, M. și Silva, J. (2000). Secvențe ale genei enterotoxinei Bacteroides fragilis la pacienții cu boală intestinală in?ammatorie. Infectologie de urgență. Dis. 6, 171-174. doi: 10.3201/eid0602.000210
CrossRef Full Text | Google Scholar
Purcell, R. V., Pearson, J., Aitchison, A., Dixon, L., Frizelle, F. A., și Keenan, J. I. (2017). Colonizarea cu Bacteroides fragilis enterotoxigenic este asociată cu neoplazia colorectală în stadiu incipient. PLoS ONE 12:e0171602. doi: 10.1371/journal.pone.0171602
PubMed Abstract | CrossRef Full Text | Google Scholar
Rafiemanesh, H., Pakzad, R., Abedi, M., Kor, Y., Moludi, J., Towhidi, F., et al. (2016). Cancerul colorectal în Iran: tendințe epidemiologice și morfologice. EXCLI J. 15, 738-744. doi: 10.17179/2Fexcli2016-346
PubMed Abstract | CrossRef Full Text | Google Scholar
Rashidan, M., Azimirad, M., Alebouyeh, M., Ghobakhlou, M., Aghdaei, H. A., și Zali, M. R. (2018). Detectarea grupului B. fragilis și diversitatea enterotoxinei bft și a markerilor de rezistență la antibiotice cepA, cfiA și nim în rândul tulpinilor de Bacteroides fragilis intestinale la pacienții cu boli inflamatorii intestinale. Anaerobe 50, 93-100. doi: 10.1016/j.anaerobe.2018.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Sears, C. L., și Garrett, W. S. (2014). Microbii, microbiota și cancerul de colon. Cell Host Microbe 15, 317-328. doi: 10.1016/j.chom.2014.02.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Sears, C. L., Geis, A. L., și Housseau, F. (2014). Bacteroides fragilis subminează biologia mucoaselor: de la simbiot la carcinogeneza colonului. J. Clin. Invest. 124, 4166-4172. doi: 10.1172/JCI72334
PubMed Abstract | Full CrossRef Text | Google Scholar
Sears, C. L., Myers, L. L. L., Lozenby, A. și Van Tassel, R. L. (1995). Bacteroides fragilis enterotoxigenic. Clin Infect Dis. 20(suppl):142-148. doi: 10.1093/clinids/20.Supplement_2.S142
CrossRef Full Text | Google Scholar
Siegel, R., DeSantis, C., și Jemal, A. (2014). Statistici privind cancerul colorectal, 2014. Cancer J. Clinic. 64, 104-117. doi: 10.3322/caac.21220
PubMed Abstract | CrossRef Full Text | Google Scholar
Swiderska, M., Choromanska, B., Dabrowska, E., Konarzewska-Duchnowska, E., Choromanska, K., Szczurko, G., et al. (2014). Diagnosticarea cancerului colorectal. Contempor Oncol. 18, 1-6. doi: 10.5114/wo.2013.39995
PubMed Abstract | Full CrossRef Text | Google Scholar
Ulger Toprak, N., Yagci, A., Gulluoglu, B. M., Akin, M. L., Demirkalem, P., Celenk, T., et al. (2006). A possible role of Bacteroides fragilis enterotoxin in the aetiology of colorectal cancer. Clin. Microbiol. Infect. 12, 782-786. doi: 10.1111/j.1469-0691.2006.01494.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Viljoen, K. S., Dakshinamurthy, A., Goldberg, P., și Blackburn, J. M. (2015). Profilarea cantitativă a bacteriilor asociate cancerului colorectal relevă asocieri între fusobacterium spp. și Bacteroides fragilis enterotoxigenic (ETBF) și caracteristicile clinicopatologice ale cancerului colorectal. PLoS ONE 10:e0119462. doi: 10.1371/journal.pone.0119462
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, S., Lim, K. C., Huang, J., Saidi, R. F., și Sears, C. L. (1998). Enterotoxina Bacteroides fragilis cleaves the zonula adherens protein, E-cadherin. Proc. Natl. acad. Sci. U.S.A. 95, 14979-14984. doi: 10.1073/pnas.95.25.14979
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, S., Morin, P. J., Mauyo, D. J. I. K., și Sears, C. (2003). Enterotoxina Bacteroides fragilis induce expresia c-myc și proliferarea celulară. Gastroenterology 124, 392-400. doi: 10.1053/gast.2003.50047
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, S., Powell, J., Mathioudakis, N., Kane, S., Fernandez, E., și Sears, C. L. (2004). Enterotoxina Bacteroides fragilis induce secreția de interleukină-8 de către celulele epiteliale intestinale prin intermediul protein kinazelor proteice activate de mitogen și o cale a factorului nuclear-kappaB reglată de tirozina-kinaza. Infect. Immun. 72, 5832-5839. doi: 10.1128/IAI.72.10.5832-5839.2004
PubMed Abstract | Cross Full Text | Google Scholar
Wu, S., Rhee, K. J., Albesiano, E., Rabizadeh, S., Wu, X., Yen, H. R., et al. (2009). Un comensal colonic uman promovează tumorigeneza colonului prin activarea răspunsurilor celulelor T helper de tip 17 T. Nat. Med. 15, 1016-1022. doi: 10.1038/nm.2015
PubMed Abstract | Real Cross Full Text | Google Scholar
Zamani, S., Shariati, S. H., Zali, M. R., Aghdaei, H. A., Asiabar, A. S., Bokaie, S., et al. (2017). Detectarea Bacteroides fragilis enterotoxigenic la pacienții cu colită ulcerativă. Gut Pathogens 9:53. doi: 10.1186/s13099-017-0202-0
PubMed Abstract | Full CrossRef Text | Google Scholar
.