Frontiers in Cellularand Infection Microbiology
Introduzione
Bacteroides fragilis, che si trova nella flora gastrointestinale degli uomini e del bestiame, è un batterio anaerobio. È uno dei principali commensali umani e uno dei più comuni Bacteroides isolati dai campioni clinici che causa diarrea, peritonite, ascessi intra-addominali, sepsi e infezioni purulente endogene (Sears et al, 1995, 2014).
È stato dimostrato che B. fragilis previene le malattie infiammatorie intestinali in animali con colite grazie alla produzione della molecola immunomodulante polisaccaride A (PSA) che induce una risposta immunitaria antinfiammatoria nel tessuto intestinale (Mazmanian et al., 2008; Lee et al., 2018). La patogenicità di B. fragilis è dovuta a diversi fattori, tra cui la capsula, le proteine della membrana esterna (OMP), e particolari enzimi che comprendono una metalloproteasi di 20 kDa denominata Bacteroides fragilis toxin (BFT) (Sears et al, 1995, 2014).
Il B. fragilis produttore di BFT, B. fragilis enterotossigeno (ETBF), è noto come causa di disturbi diarroici nell’uomo e negli animali (Myers et al., 1987; Purcell et al., 2017). L’ETBF è noto come fattore di rischio per le malattie infiammatorie intestinali (IBD) ed è presente nelle feci e nei campioni bioptici dei pazienti (Prindiville et al., 2000; Basset et al., 2004; Zamani et al., 2017). L’espressione di BFT è rivelata per scindere il dominio extracellulare di E-caderina, che è un importante costituente strutturale della zonula adherens ed è responsabile dell’adesione cellulare. Inoltre, BFT può attivare la segnalazione di B-catenina e indurre la secrezione di IL8 nelle cellule epiteliali del colon (Wu et al., 1998). Uno studio ha indicato che dopo il trattamento con BFT delle cellule HT29/C1, la perdita di E-caderina associata alla membrana ha avviato la localizzazione nucleare della ß-catenina, che ha indotto la traduzione di c-myc e ha portato a una proliferazione cellulare persistente (Wu et al., 2003). La potenza del BFT e la sua influenza sulla struttura e la fisiologia dell’epitelio gastrointestinale suggeriscono che la presenza dell’ETBF può contribuire alle malattie croniche del colon, compresa la trasformazione oncogenica, l’infiammazione intestinale, le disfunzioni croniche del colon e le lesioni precancerose e cancerose del colon-retto (Wu et al, 1998, 2003; Sears et al., 2014).
Il cancro del colon-retto (CRC) è uno dei tumori più diffusi in tutto il mondo e comprende il 9% di tutti i tumori ed è la quarta causa di morte per cancro in tutto il mondo (Sears et al., 1995; Ferlay et al., 2015). Tuttavia, c’è una differenza significativa tra i paesi nell’incidenza standardizzata per età di questo cancro; il tasso di incidenza negli Stati Uniti e nei paesi europei è più di 25 volte quello dei paesi africani e asiatici. Il tasso di morbilità e mortalità del CRC si è ridotto negli ultimi anni grazie al miglioramento dei test di screening che possono rilevare le modificazioni colorettali in fasi più precoci e ai miglioramenti dei farmaci e delle procedure (Boyle e Langman, 2000; Rafiemanesh et al, 2016).
CRC è uno dei tumori più comuni in Iran ed è il terzo tumore più comune tra gli uomini iraniani (8,1-8,3 per 100.000 popolazioni) e il quarto più diffuso tra le donne iraniane (6,5-7,5 per 100.000 popolazioni) (Moghimi-Dehkordi et al., 2008; Kolahdoozan et al., 2010). I fattori di rischio del CRC sono l’obesità, lo stile di vita sedentario, la dieta ricca di grassi, la dieta povera di verdure e frutta, il fumo, l’abuso di alcol e i farmaci antinfiammatori non steroidei (FANS). Infiammazione cronica, IBD, polipi, adenoma e displasia causano cambiamenti alle cellule del colon e le rendono inclini al cancro (Boyle e Langman, 2000; Johnson et al., 2013).
L’incidenza e la mortalità del CRC stanno diminuendo nelle nazioni occidentali sviluppate, mentre la sua incidenza sta aumentando tra entrambi i sessi durante gli ultimi decenni in Iran a causa dello stile di vita e dei cambiamenti nella dieta. Un’altra ragione di questa diminuzione può essere l’aumento del numero di strutture e il miglioramento delle attrezzature e della tecnologia, in quanto più persone si rivolgono alle strutture sanitarie per lo screening, mentre in passato, una persona potrebbe aver avuto un cancro e anche essere morta, ma il cancro è andato non diagnosticato a causa della mancanza di attrezzature e strutture (Malekzadeh et al., 2009; Siegel et al, 2014).
In questo studio, la frequenza e l’abbondanza di ETBF nei campioni bioptici dei pazienti con CRC e condizioni precancerose sono stati confrontati con quelli degli individui senza storia personale o familiare di malattia colorettale per indagare l’associazione tra la presenza di BFT e sviluppo del tumore.
Materiali e metodi
Pazienti e campioni
In questo studio caso-controllo, 120 biopsie della mucosa sono state raccolte da pazienti iraniani con condizioni precancerose e CRC (n = 68) e gruppo di controllo (n = 52) utilizzando la colonscopia. I pazienti con precancerosi (lesioni seghettate, adenoma includono displasia di basso grado: LGD e displasia di alto grado: HGD) e condizioni cancerose (cancro colorettale: CRC) che hanno fatto riferimento all’ospedale Imam Khomeini di Teheran tra marzo 2015 e gennaio 2017 sono stati selezionati per partecipare a questo studio. Il Comitato Etico dell’Università di Scienze Mediche di Teheran ha approvato il protocollo dello studio. Inoltre, il consenso informato è stato ottenuto da tutti i partecipanti. Tutti i pazienti sono stati diagnosticati in base ai sintomi clinici e agli standard istologici e radiografici, che hanno mostrato caratteristiche tipiche con una distribuzione speciale (Swiderska et al., 2014). Tutti i dati su età, sesso e tipo di lesioni sono stati recuperati dalle cartelle cliniche dei pazienti. Tutti i pazienti che entrano nello studio sono stati diagnosticati al momento della colonscopia e la chemioterapia non ha iniziato a trattarli.
Durante lo stesso periodo, 52 controlli sani, senza storia personale o familiare di malattia colorettale diagnostica, la cui età e sesso corrispondevano a quelli dei pazienti sono stati inclusi nello studio come controlli. Una storia recente di diarrea e IBD era un criterio di esclusione per i controlli. Nessuno degli individui che hanno preso parte a questo studio ha usato antibiotici o probiotici negli ultimi 3 mesi. Tutti i campioni sono stati mantenuti in un contenitore sterile con un mezzo di tioglicolato (Merck, Germania) e trasportati al laboratorio in condizioni anaerobiche per una manipolazione immediata. Inoltre, 2 biopsie della mucosa sono state raccolte da ogni paziente per la coltura e l’estrazione del DNA.
Cultura batterica
Due omogeneizzatori di vetro sono stati utilizzati per la rottura meccanica e l’omogeneizzazione di tutte le biopsie; poi, sono state coltivate su Bacteroides Bile Esculin agar (BBE) (Himedia Laboratories Pvt. Ltd, India). In questo studio, è stato utilizzato il sistema Anoxomat (MART Microbiology Drachten, Paesi Bassi) per fornire condizioni atmosferiche gassose per gli anaerobi; quindi, le piastre sono state incubate in una camera anaerobica a 37°C per 72 ore. Inoltre, B. fragilis è stato confermato utilizzando il metodo della PCR in tempo reale.
Estrazione del DNA
Il DNA è stato estratto direttamente dal tessuto bioptico utilizzando il kit RTP® Mycobacteria (Invitek, Berlino, Germania). La densità ottica (OD) del DNA estratto è stata determinata a 260 nanometri. Poi, il DNA è stato conservato a -20°C per le successive analisi e la PCR in tempo reale.
Real-Time PCR
Le sequenze del gene bft e 16S rRNA sono state recuperate dalla Gene bank. I primer e le sonde sono stati progettati utilizzando il primer 3 plus (http://www.bioinformatics.nl/cgi-bin/primer3plus/primer3plus.cgi). Tutti i primer e le sonde utilizzati per il rilevamento di tutti i tipi di gene bft erano stati progettati nel nostro studio precedente (Zamani et al., 2017). Per rilevare i sottotipi del gene bft, la PCR in tempo reale è stata eseguita come precedentemente descritto (Merino et al., 2011).
Il DNA genomico del ceppo ETBF D-134 e il clone RIGLD 1 sono stati utilizzati come controlli positivi (Rashidan et al., 2018). Il controllo negativo era PCR TaqMan master mix con acqua distillata al posto del DNA.
Il DNA standard è stato preparato per l’amplificazione e il numero di molecole del template per grammo è stato calcolato dalla formula definita (Zamani et al., 2017). La curva standard per il bft e il gene 16S rRNA è stata valutata utilizzando ogni primer e sonda con una diluizione seriale di 10 volte di campioni di DNA di B. fragilis, corrispondente a 101-106 valori medi per grammo di biopsie.
Secondo la curva standard e l’intercetta dell’y, i campioni che non hanno mostrato il segnale fluorescente prima del Ct di 38 sono stati determinati come negativi. Inoltre, i campioni che hanno prodotto una fluorescenza di un valore Ct ≤ 10 sono stati diluiti. L’efficacia della PCR in tempo reale è stata determinata come E = 10(-1/slop) – 1 (Zamani et al., 2017).
Dopo l’ottimizzazione delle curve standard, la serie di diluizioni è stata messa in ogni corsa di amplificazione. I test di PCR in tempo reale sono stati valutati utilizzando lo strumento LinGene K Real Time PCR (Bioer, Hangzhou, PR, Cina). Tutti i test sono stati fatti in un volume di 25 μL (Zamani et al., 2017). Per garantire la qualità, tutti gli esperimenti sono stati ripetuti per una seconda volta in modo indipendente e le medie sono state riportate.
Per controllare la specificità della PCR e la dimensione prevista del prodotto, i primer sono stati applicati in una PCR convenzionale e gli ampliconi sono stati eseguiti sul gel di agarosio. Inoltre, la specificità dei frammenti amplificati positivi è stata dimostrata dal sequenziamento. Il prodotto della PCR è stato inviato alla Macrogen Corporation della Corea del Sud per il sequenziamento. I risultati del sequenziamento sono stati analizzati con il software Chromas 2.6. Poi, tutte le sequenze sono state inserite nel database NCBI (https://blast.ncbi.nlm.nih.gov/Blast.cgi). In tutti gli isolati sequenziati la percentuale di somiglianza con i geni correlati (gene 16s rRNA e gene bft) presenti nel database NCBI era superiore al 95%.
Analisi statistica
I risultati sono stati confrontati utilizzando i test esatto di Fisher, Chi quadrato e Mann-Whitney. P < 0,05 è stato considerato statisticamente significativo. Inoltre, i valori medi ± Std. error of mean (SEM) sono stati calcolati per B. fragilis e ETBF. I dati sono stati analizzati utilizzando il software statistico SPSS 13.0.
In questo studio, la regressione logistica condizionale è stata utilizzata per valutare gli odds ratio (OR) e gli intervalli di confidenza al 95%. In questo disegno, l’odds ratio è uno stimatore coerente del tasso di CRC quando esposto con ETBF rispetto ai soggetti non esposti.
Risultati
In questo studio, 68 campioni sono stati raccolti da pazienti con CRC (36 maschi e 32 femmine; età media: 55 anni; range: 35-78) e 52 campioni sono stati presi da controlli sani (HC) (30 maschi e 22 femmine; età media: 56 anni; range: 42-78). Tutti i pazienti diagnosticati sulla base di procedure di colonscopia al momento del campionamento. Tutti i pazienti diagnosticati al momento della colonscopia dando un totale di 26 di pazienti con CRC invasivo, 18 di pazienti con lesioni seghettate, 24 pazienti con adenoma includono 14 pazienti con LGD e 10 di pazienti con HGD secondo la classificazione corrente (Figura 1). Queste biopsie sono state raccolte dal lato destro (ascendente), dal lato sinistro (discendente) e da entrambi i lati in 22, 32 e 14 pazienti, rispettivamente (Tabella 1).
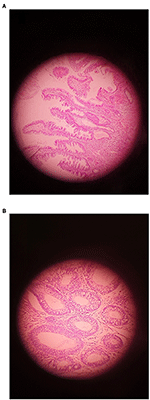
Figura 1. Un esempio di adenoma che mostra (A) LGD e (B) HGD (ingrandimento originale ×400).
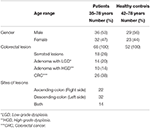
Tabella 1. Caratteristiche dei pazienti e degli HC.
I risultati della coltura di B. fragilis erano positivi per 31 (51%) e 25 (48%) campioni dei pazienti e dei controlli sani, rispettivamente (Tabella 2) (P = 0,7).

Tabella 2. Dati sulla coltura di Bacteroides fragilis.
Secondo la curva standard, le diluizioni del DNA ETBF (controllo positivo) a 101, 102, 103, 104, 105, e 106 hanno fornito valori Ct di 15.08 ± 0.1, 18.04 ± 0.2, 21.42 ± 0.2, 25.02 ± 0.2, 28.02 ± 0.4, e 31.96 ± 0.4, rispettivamente. L’efficienza della PCR in tempo reale era tra il 98 e il 100%.
I campioni positivi per il gene 16S rRNA e il gene bft erano il 63 e il 47% nei pazienti. Tuttavia, i risultati positivi sono stati mostrati in 81 e 3,8% dei campioni HC, rispettivamente (Tabella 3). La differenza tra la positività del gene bft nei pazienti e negli HC era statisticamente significativa (P = 0,00).
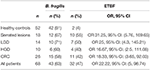
Tabella 3. Il numero di campioni positivi per il gene 16S rRNA e i geni bft nei gruppi clinicopatologici e HC.
Anche il numero di campioni positivi ai geni bft in CRC e HC all’interno dei gruppi clinicopatologici è mostrato nella tabella 3. Il più alto OR è stato trovato nel gruppo delle lesioni seghettate seguito dalle lesioni adenomatose con gruppo LGD. Anche l’OR per tutti i pazienti (OR 22.22, 95% CI: 5, 98.74) ha descritto l’associazione di ETBF e l’esistenza di lesioni.
I risultati dell’analisi quantitativa della PCR in tempo reale per il gene 16S rRNA contato per B. fragilis e il gene bft contato per ETBF per ng di DNA sono stati mostrati nella Tabella 4. La differenza tra i numeri di copie del gene 16S rRNA nei pazienti e negli HC non era statisticamente significativa (P ≥ 0,05). Il numero di copie del gene bft era maggiore nei campioni dei pazienti che in quelli dei controlli sani (P = 0,00). Inoltre, il numero di copie del gene bft era maggiore nei campioni ETBF positivi nel gruppo delle lesioni precursori rispetto a quelli con CRC; tuttavia, questa differenza non era statisticamente significativa. I risultati del sequenziamento hanno confermato la presenza dei geni bft e 16S rRNA (foglio dati 1).
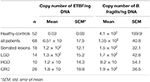
Tabella 4. Analisi quantitativa del gene 16S rRNA e dei geni bft nei gruppi clinicopatologici e HC.
Inoltre, i risultati di questi campioni hanno indicato che il sottotipo più prevalente del gene bft era bft1 seguito da bft2. Dei 32 isolati portatori del gene bft, 18 (56,2%) sono stati sottotipizzati come bft-1 e 14 (43,7%) come bft-2. Inoltre, il gene bft è stato rilevato in 2 dei campioni HC, e tutti sono stati sottotipizzati come bft-1. Nessun campione di DNA ha ospitato il sottotipo bft-3.
Discussione
C’è una crescente evidenza per l’effetto della disbiosi microbica nell’intestino, l’inizio e lo sviluppo del cancro colorettale (Sears e Garrett, 2014; Gagniere et al., 2016). Anche se l’incidenza di CRC è stata riportata più bassa in Iran rispetto ad altri paesi, il suo tasso è stato previsto per aumentare in futuro (Hosseini et al., 2004; Malekzadeh et al., 2009). In studi precedenti, è stato anche riportato che ETBF può avere un ruolo nella diarrea e IBD (Myers et al., 1987; Prindiville et al., 2000; Basset et al., 2004; Merino et al., 2011; Purcell et al., 2017; Zamani et al, 2017).
Alcune indagini hanno suggerito che alcune specie batteriche (ad esempio, ETBF) possono operare come batteri patogeni che chiariscono lo sviluppo di disbiosi nella comunità microbica dell’intestino e innescano CRC (Hajishengallis et al., 2012; Hajishengallis e Lamont, 2016). La tumorigenesi del colon-retto è stata indotta dalle risposte immunitarie e dall’attivazione di citochine proinfiammatorie dovute al BFT (Wu et al., 2004, 2009).
I risultati di questo studio hanno indicato che l’ETBF era significativamente associato alle lesioni seghettate seguite da LGD. L’odds ratio più elevato in queste lesioni ha anche dimostrato che l’esposizione all’ETBF è un fattore di rischio per gli stati cancerosi e soprattutto precancerosi. Questo supporta l’ipotesi che i ceppi che producono BFT possono avere un ruolo importante nell’innescare l’infiammazione e la risposta immunologica in persone geneticamente suscettibili e possono portare al CRC. Il primo studio che dimostra una maggiore prevalenza di ETBF nei campioni di feci di pazienti con cancro colorettale (38%) rispetto al gruppo di controllo (12%) è stato condotto da Ulger Toprak et al. (2006). Inoltre, alcuni rapporti precedenti hanno mostrato un’associazione tra il gene bft e il CRC, in particolare nella fase avanzata del CRC (Dejea et al., 2014; Boleij et al., 2015; Viljoen et al., 2015). Uno studio condotto da Purcell et al. ha dimostrato associazioni significative di ETBF con adenomi tubulari, lesioni seghettate e displasia di basso grado, che era simile ai risultati del presente studio (Purcell et al., 2017).
In questo studio, le lesioni precursori, comprese quelle con displasia di basso grado, hanno mostrato una tendenza crescente nella quantità di gene bft rispetto a quelle con CRC; tuttavia, questa differenza non era statisticamente significativa. Inoltre, gli autori hanno precedentemente riportato che i marcatori ETBF sono stati osservati nel colon e nell’ileo terminale dei pazienti con colite ulcerosa che sono predisposti al CRC (Zamani et al., 2017; Rashidan et al., 2018). Allo stesso modo, in uno studio precedente, è stato rilevato solo il sottotipo bft1 di questo gene (Zamani et al., 2017). Sebbene il gene bft1 fosse il sottotipo più prevalente, in questo studio è stato trovato anche il gene bft2.
In questo studio, l’ETBF è stato rilevato nelle lesioni dei pazienti CRC, e risultati simili sono stati anche precedentemente riportati da altri investigatori che hanno studiato l’ETBF in campioni di mucosa colonica (Boleij et al., 2015; Viljoen et al., 2015). Studi recenti sul ruolo del microbioma intestinale hanno dimostrato che la disbiosi della comunità microbica si verifica nelle regioni non tumorali e tumorali dei pazienti CRC (Dejea et al., 2014; Flemer et al., 2017; Purcell et al., 2017). In questi studi hanno mostrato che alcuni dei batteri tra cui Fusobacterium nucleatum, ETBF, Escherichia coli, Streptococcus gallolyticus e Enterococcus faecalis e batteri produttori di butirrato possono svolgere ruoli importanti nello sviluppo del CRC (Dejea et al, 2014; Flemer et al., 2017; Park et al., 2018).
I risultati della PCR in tempo reale per il rilevamento di B. fragilis hanno mostrato che più percentuale dei pazienti e HC conteneva B. fragilis rispetto al metodo di cultura. Il metodo gold standard per il rilevamento di batteri è basato sulla cultura, ma richiede un elevato numero di cellule vitali e in particolare per la cultura di batteri anaerobi, alcune limitazioni potrebbero verificarsi. Può essere che queste limitazioni influenzino la differenza tra i risultati.
Le differenze nelle colture di B. fragilis e i risultati della PCR in tempo reale tra i controlli e i campioni CRC non sono significativi. Questi dati suggeriscono che probabilmente i ceppi che ospitano il gene bft, non B. fragilis da solo, potrebbero contribuire al CRC in questo studio. È stato dimostrato che B. fragilis è un importante commensale umano, quindi questo batterio può essere isolato anche dai controlli sani come i pazienti. Ma nei pazienti con lesioni cancerose e precancerose alcuni dei ceppi che contengono geni bft sono aumentati e questa disbiosi può indurre l’infiammazione. Inoltre alcuni studi hanno dimostrato che il B. fragilis commensale umano ha impedito lo sviluppo della colite e può fornire un’efficace strategia terapeutica per CRC mentre vari studi suggeriscono che i ceppi enterotossigenici di questo batterio sono associati ai tumori intestinali a causa della produzione di enterotossine (Sears et al., 1995, 2014; Mazmanian et al., 2008; Lee et al., 2018).
Ci sono state alcune limitazioni in questo studio. Sono stati utilizzati diversi metodi per diagnosticare il gene bft, che è stato estratto direttamente dai tessuti tumorali nel colon dei pazienti. Pertanto, la conduzione di un grande studio di coorte basato sulla popolazione è altamente raccomandata. Inoltre, sono necessarie ulteriori indagini per dimostrare una possibile correlazione tra la presenza del gene bft e le lesioni seghettate, LGD e CRC.
Conclusioni
I risultati di questo studio suggeriscono che l’ETBF potrebbe essere presente nelle biopsie mucosali dei pazienti con condizioni precancerose, come le lesioni seghettate e LGD, oltre ai pazienti CRC. Un’associazione significativa è stata trovata tra la presenza di ETBF nei tessuti colpiti e il numero di questi batteri nei campioni dei pazienti, soprattutto nelle lesioni precancerose cancerose: adenomi con displasia di basso grado e lesioni seghettate. Infatti l’ETBF è più spesso rilevato nelle lesioni precoci, ma ulteriori ricerche con un numero maggiore di campioni sembrano essere utili per determinare con precisione.
Anche ulteriori ricerche sono necessarie per determinare se l’età, il sesso, la dieta e altri fattori ambientali influenzano la diagnosi di ETBF negli esseri umani nel tempo.
Infine, l’ETBF potrebbe essere un marcatore della prognosi del CRC, in particolare nelle lesioni precancerose, e potrebbe essere utilizzato per lo screening di questi disturbi.
Data Availability Statement
I dati grezzi che supportano le conclusioni di questo manoscritto saranno resi disponibili dagli autori, senza indebite riserve, a qualsiasi ricercatore qualificato.
Ethics Statement
Gli studi che coinvolgono partecipanti umani sono stati rivisti e approvati dal Comitato Etico dell’Università di Scienze Mediche di Teheran. I pazienti/partecipanti hanno fornito il loro consenso informato scritto per partecipare a questo studio.
Contributi degli autori
SZ è il primo autore che ha eseguito tutti gli esperimenti di laboratorio, raccolto e analizzato i dati, e redatto il manoscritto. RT è il gastroenterologo che ha fatto la colonscopia e ha fornito i campioni di tutti i casi. LS ha partecipato alla progettazione e al coordinamento dello studio e ha dato consigli in tutte le parti dello studio. AS e SJ hanno partecipato alla raccolta dei campioni e all’esecuzione dei test. MF ha supervisionato tutte le parti dello studio. Tutti gli autori hanno letto e approvato il manoscritto.
Finanziamento
Questo lavoro è stato sostenuto dalla Tehran University of Medical Sciences (Grant No: 32467).
Conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di qualsiasi relazione commerciale o finanziaria che potrebbe essere interpretata come un potenziale conflitto di interessi.
Riconoscimenti
Gli autori vorrebbero ringraziare il personale dell’ospedale Imam Khomeini per il loro gentile supporto nella raccolta dei campioni.
Materiale supplementare
Il materiale supplementare per questo articolo può essere trovato online su: https://www.frontiersin.org/articles/10.3389/fcimb.2019.00449/full#supplementary-material
Foglio dati 1. I risultati del sequenziamento dei geni bft e 16S rRNA in un isolato.
Basset, C., Holton, J., Bazeos, A., Vaira, D., e Bloom, S. (2004). Sono specie Helicobacter e Bacteroides fragilis enterotossigeni coinvolti nella malattia intestinale inamatoriale? Dig. Dis. Sci. 49, 1425-1432. doi: 10.1023/B:DDAS.0000042241.13489.88
CrossRef Full Text | Google Scholar
Boleij, A., Hechenbleikner, E. M., Goodwin, A. C., Badani, R., Stein, E. M., Lazarev, M. G., et al. (2015). Il gene della tossina Bacteroides fragilis è prevalente nella mucosa del colon di pazienti con cancro colorettale. Clin. Infect. Dis. 60, 208-215. doi: 10.1093/cid/ciu787
PubMed Abstract | CrossRef Full Text | Google Scholar
Boyle, P., e Langman, J. (2000). ABC del cancro colorettale: epidemiologia. BMJ 321, 805-808. doi: 10.1136/bmj.321.7264.805
PubMed Abstract | CrossRef Full Text | Google Scholar
Dejea, C. M., Wick, E. C., Hechenbleikner, E. M., White, J. R., Mark Welch, J. L., Rossetti, B. J., et al. (2014). Organizzazione del microbiota è una caratteristica distinta di tumori colorettali prossimali. Proc. Natl. Acad. Sci. U.S.A. 111, 18321-18326. doi: 10.1073/pnas.1406199111
PubMed Abstract | CrossRef Full Text | Google Scholar
Ferlay, J., Soerjomataram, I., Dikshit, R., Eser, S., Mathers, C., Rebelo, M., et al. (2015). Incidenza e mortalità del cancro nel mondo: fonti, metodi e modelli principali in GLOBOCAN 2012. Int. J. Cancer 136, E359-E386. doi: 10.1002/ijc.29210
PubMed Abstract | CrossRef Full Text | Google Scholar
Flemer, B., Lynch, D. B., Brown, J. M., Jeffery, I. B., Ryan, F. J., Claesson, M. J., et al. (2017). Microbiota associato al tumore e non associato al tumore nel cancro colorettale. Gut 66, 633-643. doi: 10.1136/gutjnl-2015-309595
PubMed Abstract | CrossRef Full Text | Google Scholar
Gagniere, J., Raisch, J., Veziant, J., Barnich, N., Bonnet, R., Buc, E., et al. (2016). Squilibrio del microbiota intestinale e cancro del colon-retto. Mondo J. Gastroenterol. 22, 501-518. doi: 10.3748/wjg.v22.i2.501
PubMed Abstract | CrossRef Full Text | Google Scholar
Hajishengallis, G., Darveau, R. P., e Curtis, M. A. (2012). La chiave di volta-patogeno ipotesi. Nat. Rev. Microbiol. 10, 717-725. doi: 10.1038/nrmicro2873
PubMed Abstract | CrossRef Full Text | Google Scholar
Hajishengallis, G., e Lamont, R. J. (2016). Ballando con le stelle: come coreografato interazioni batteriche dettare nosymbiocity e dare origine a patogeni chiave di volta, patogeni accessori, e patobionti. Trends Microbiol. 24, 477-489. doi: 10.1016/j.tim.2016.02.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Hosseini, S. V., Izadpanah, A., e Yarmohammadi, H. (2004). Cambiamenti epidemiologici nel cancro colorettale a Shiraz, Iran: 1980-2000. ANZ J. Surg. 74, 547-549. doi: 10.1111/j.1445-2197.2004.03064.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Johnson, C. M., Wei, C., Ensor, J. E., Smolenski, D. J., Amos, C. I., Levin, B., et al. Meta-analisi dei fattori di rischio del cancro colorettale. Cancer Causes Control. 24:120722. doi: 10.1007/s10552-013-0201-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Kolahdoozan, S., Sadjadi, A., Radmard, A. R., e Khademi, H. (2010). Cinque tumori comuni in Iran. Arch. Iran Med. 13, 143-146.
PubMed Abstract | Google Scholar
Lee, Y. K., Mehrabian, P., Boyajian, S., Wu, W. L., Selicha, J., Vonderfecht, S., et al. (2018). Il ruolo protettivo di bacteroides fragilis in un modello murino di cancro colorettale associato a colite. mSphere. 3:e00587-e00518. doi: 10.1128/mSphere.00587-18
PubMed Abstract | CrossRef Full Text | Google Scholar
Malekzadeh, R., Bishehsari, F., Mahdavinia, M., e Ansari, R. (2009). Epidemiologia e genetica molecolare del cancro colorettale in Iran: una revisione. Arch. Iran Med. 12:161-169.
PubMed Abstract | Google Scholar
Mazmanian, S. K., Round, J. L., e Kasper, D. L. (2008). Un fattore di simbiosi microbica impedisce la malattia infiammatoria intestinale. Natura. 453, 620-625. doi: 10.1038/nature07008
PubMed Abstract | CrossRef Full Text | Google Scholar
Merino, V. R., Nakano, V., Liu, C., Song, Y., Finegold, S. M., e Avila-Campos, M. J. (2011). Rilevamento quantitativo di sottotipi di Bacteroides fragilis enterotossigeni isolati da bambini con e senza diarrea. J. Clin. Microbiol. 49, 416-418. doi: 10.1128/JCM.01556-10
PubMed Abstract | CrossRef Full Text | Google Scholar
Moghimi-Dehkordi, B., Safaee, A., and Zali, M. (2008). Fattori prognostici in 1.138 pazienti iraniani con cancro colorettale. Int. J. Colorect. Dis. 23, 683-688. doi: 10.1007/s00384-008-0463-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Myers, L. L., Shoop, D. S., Stackhouse, L. L., Newman, F. S., Flaherty, R. J., Letson, G. W., et al. (1987). Isolamento di Bacteroides fragilis enterotossigeno da esseri umani con diarrea. J. Clin. Microbiol. 25, 2230-2233.
Google Scholar
Park, C. H., Eun, C. S., and Han, D. S. (2018). Microbiota intestinale, infiammazione cronica e cancro colorettale. Intest. Res. 16:338. doi: 10.5217/ir.2018.16.3.338
PubMed Abstract | CrossRef Full Text | Google Scholar
Prindiville, T., Sheikh, R., Cohen, S., Tang, Y., Cantrell, M., e Silva, J. (2000). Bacteroides fragilis enterotossina sequenze di geni in pazienti con malattia intestinale ammatory. Emerg. Infect. Dis. 6, 171-174. doi: 10.3201/eid0602.000210
CrossRef Full Text | Google Scholar
Purcell, R. V., Pearson, J., Aitchison, A., Dixon, L., Frizelle, F. A., and Keenan, J. I. (2017). La colonizzazione con Bacteroides fragilis enterotossigenico è associata alla neoplasia colorettale in fase iniziale. PLoS ONE 12:e0171602. doi: 10.1371/journal.pone.0171602
PubMed Abstract | CrossRef Full Text | Google Scholar
Rafiemanesh, H., Pakzad, R., Abedi, M., Kor, Y., Moludi, J., Towhidi, F., et al. (2016). Il cancro del colon-retto in Iran: epidemiologia e tendenze morfologiche. EXCLI J. 15, 738-744. doi: 10.17179/2Fexcli2016-346
PubMed Abstract | CrossRef Full Text | Google Scholar
Rashidan, M., Azimirad, M., Alebouyeh, M., Ghobakhlou, M., Aghdaei, H. A., e Zali, M. R. (2018). Rilevamento del gruppo B. fragilis e diversità dell’enterotossina bft e dei marcatori di resistenza agli antibiotici cepA, cfiA e nim tra i ceppi intestinali di Bacteroides fragilis in pazienti con malattie infiammatorie intestinali. Anaerobe 50, 93-100. doi: 10.1016/j.anaerobe.2018.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Sears, C. L., and Garrett, W. S. (2014). Microbi, microbiota e cancro al colon. Cell Host Microbe 15, 317-328. doi: 10.1016/j.chom.2014.02.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Sears, C. L., Geis, A. L., e Housseau, F. (2014). Bacteroides fragilis sovverte la biologia delle mucose: da simbionte a carcinogenesi del colon. J. Clin. Invest. 124, 4166-4172. doi: 10.1172/JCI72334
PubMed Abstract | CrossRef Full Text | Google Scholar
Sears, C. L., Myers, L. L., Lozenby, A., e Van Tassel, R. L. (1995). Enterotoxigenic Bacteroides fragilis. Clin Infect Dis. 20(suppl):142-148. doi: 10.1093/clinids/20.Supplement_2.S142
CrossRef Full Text | Google Scholar
Siegel, R., DeSantis, C., e Jemal, A. (2014). Statistiche sul cancro colorettale, 2014. Cancer J. Clinic. 64, 104-117. doi: 10.3322/caac.21220
PubMed Abstract | CrossRef Full Text | Google Scholar
Swiderska, M., Choromanska, B., Dabrowska, E., Konarzewska-Duchnowska, E., Choromanska, K., Szczurko, G., et al. (2014). La diagnostica del cancro colorettale. Contempor Oncol. 18, 1-6. doi: 10.5114/wo.2013.39995
PubMed Abstract | CrossRef Full Text | Google Scholar
Ulger Toprak, N., Yagci, A., Gulluoglu, B. M., Akin, M. L., Demirkalem, P., Celenk, T., et al. (2006). Un possibile ruolo della enterotossina di Bacteroides fragilis nell’eziologia del cancro colorettale. Clin. Microbiol. Infect. 12, 782-786. doi: 10.1111/j.1469-0691.2006.01494.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Viljoen, K. S., Dakshinamurthy, A., Goldberg, P., e Blackburn, J. M. (2015). Profilazione quantitativa di batteri associati al cancro del colon-retto rivela associazioni tra fusobacterium spp., enterotoxigenic Bacteroides fragilis (ETBF) e caratteristiche clinicopatologiche del cancro colorettale. PLoS ONE 10:e0119462. doi: 10.1371/journal.pone.0119462
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, S., Lim, K. C., Huang, J., Saidi, R. F., e Sears, C. L. (1998). Bacteroides fragilis enterotossina scinde la proteina zonula adherens, E-caderina. Proc. Natl. Acad. Sci. U.S.A. 95, 14979-14984. doi: 10.1073/pnas.95.25.14979
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, S., Morin, P. J., Mauyo, D. J. I. K., e Sears, C. (2003). Bacteroides fragilis enterotossina induce c-myc espressione e proliferazione cellulare. Gastroenterology 124, 392-400. doi: 10.1053/gast.2003.50047
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, S., Powell, J., Mathioudakis, N., Kane, S., Fernandez, E., e Sears, C. L. (2004). L’enterotossina di Bacteroides fragilis induce la secrezione di cellule epiteliali intestinali di interleuchina-8 attraverso le protein chinasi attivate da mitogeni e un percorso del fattore nucleare-kappaB regolato da tirosin-chinasi. Infect. Immun. 72, 5832-5839. doi: 10.1128/IAI.72.10.5832-5839.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, S., Rhee, K. J., Albesiano, E., Rabizadeh, S., Wu, X., Yen, H. R., et al. Un commensale colonico umano promuove la tumorigenesi del colon attraverso l’attivazione delle risposte delle cellule T helper tipo 17. Nat. Med. 15, 1016-1022. doi: 10.1038/nm.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Zamani, S., Shariati, S. H., Zali, M. R., Aghdaei, H. A., Asiabar, A. S., Bokaie, S., et al. Rilevamento di Bacteroides fragilis enterotossigenico in pazienti con colite ulcerosa. Gut Pathogens 9:53. doi: 10.1186/s13099-017-0202-0
PubMed Abstract | CrossRef Full Text | Google Scholar