Frontiers in Cellularand Infection Microbiology
Introduction
Bacteroides fragilis je anaerobní bakterie. Je to jeden z významných lidských komenzálů a jeden z nejčastěji izolovaných Bacteroides z klinických vzorků, který způsobuje průjmy, peritonitidy, nitrobřišní abscesy, sepse a endogenní hnisavé infekce (Sears et al., 1995, 2014).
Ukázalo se, že B. fragilis zabraňuje střevním zánětlivým onemocněním u zvířat s kolitidou díky produkci imunomodulační molekuly polysacharidu A (PSA), která vyvolává protizánětlivou imunitní odpověď ve střevní tkáni (Mazmanian et al., 2008; Lee et al., 2018). Patogenita B. fragilis je způsobena několika faktory, včetně kapsidy, proteinů vnější membrány (OMP) a speciálních enzymů, které tvoří 20 kDa metaloproteázu označovanou jako toxin Bacteroides fragilis (BFT) (Sears et al., 1995, 2014).
BFT produkující B. fragilis, enterotoxigenní B. fragilis (ETBF), je znám jako původce průjmových onemocnění u lidí a zvířat (Myers et al., 1987; Purcell et al., 2017). ETBF je znám jako rizikový faktor zánětlivých střevních onemocnění (IBD) a je přítomen ve stolici a bioptických vzorcích pacientů (Prindiville et al., 2000; Basset et al., 2004; Zamani et al., 2017). Ukázalo se, že exprese BFT štěpí extracelulární doménu E-kadherinu, který je hlavní strukturní složkou zonula adherens a je zodpovědný za buněčnou adhezi. Kromě toho může BFT aktivovat signalizaci B-kateninu a indukovat sekreci IL8 v epiteliálních buňkách tlustého střeva (Wu et al., 1998). Studie ukázala, že po ošetření buněk HT29/C1 BFT ztráta membránově asociovaného E-cadherinu iniciovala jadernou lokalizaci ß-kateninu, což indukovalo translaci c-myc a vedlo k přetrvávající buněčné proliferaci (Wu et al., 2003). Účinnost BFT a jeho vliv na strukturu a fyziologii gastrointestinálního epitelu naznačují, že přítomnost ETBF může přispívat k chronickým onemocněním tlustého střeva, včetně onkogenní transformace, střevního zánětu, chronických dysfunkcí tlustého střeva a přednádorových a nádorových lézí tlustého střeva (Wu et al., 1998, 2003; Sears et al., 2014).
Kolorektální karcinom (CRC) je jedním z nejrozšířenějších nádorových onemocnění na světě a tvoří 9 % všech nádorových onemocnění a je čtvrtou příčinou úmrtí na rakovinu na světě (Sears et al., 1995; Ferlay et al., 2015). Mezi jednotlivými zeměmi však existuje významný rozdíl ve věkově standardizované incidenci této rakoviny; v USA a evropských zemích je incidence více než 25krát vyšší než v afrických a asijských zemích. Míra nemocnosti a úmrtnosti na CRC se v posledních letech snižuje díky zdokonaleným screeningovým testům, které dokáží odhalit kolorektální modifikace v časnějších stadiích, a zdokonalení léků a postupů (Boyle a Langman, 2000; Rafiemanesh et al.,
CRC je jedním z nejčastějších nádorových onemocnění v Íránu a je třetím nejčastějším nádorovým onemocněním u íránských mužů (8,1-8,3 na 100 000 obyvatel) a čtvrtým nejčastějším nádorovým onemocněním u íránských žen (6,5-7,5 na 100 000 obyvatel) (Moghimi-Dehkordi et al., 2008; Kolahdoozan et al., 2010). Rizikovými faktory CRC jsou obezita, sedavý způsob života, strava s vysokým obsahem tuku, strava s nízkým obsahem zeleniny a ovoce, kouření, zneužívání alkoholu a nesteroidní protizánětlivé léky (NSAID). Chronický zánět, IBD, polypy, adenomy a dysplazie způsobují změny buněk tlustého střeva a činí je náchylnými k rakovině (Boyle a Langman, 2000; Johnson et al., 2013).
V rozvinutých západních zemích incidence a mortalita CRC klesá, zatímco v Íránu se jeho výskyt v posledních desetiletích zvyšuje u obou pohlaví v důsledku změn životního stylu a stravování. Dalším důvodem tohoto poklesu může být nárůst počtu zařízení a zdokonalení vybavení a technologií, protože stále více lidí se obrací na zdravotnická zařízení za účelem screeningu, zatímco v minulosti mohl mít člověk rakovinu a dokonce zemřít, ale rakovina zůstala nediagnostikována kvůli nedostatku vybavení a zařízení (Malekzadeh et al., 2009; Siegel et al., 2014).
V této studii byly frekvence a množství ETBF v bioptických vzorcích pacientů s CRC a prekancerózami porovnány s jedinci bez osobní nebo rodinné anamnézy kolorektálního onemocnění, aby se zjistila souvislost mezi přítomností BFT a vznikem nádoru.
Materiál a metody
Pacienti a vzorky
V této kontrolní studii bylo pomocí kolonoskopie odebráno 120 slizničních biopsií od íránských pacientů s prekancerózou a CRC (n = 68) a kontrolní skupiny (n = 52). Pacienti s prekancerózou (Serrated lesions, Adenoma include Low-grade Dysplasia: LGD a high-grade dysplazie: HGD) a nádorových stavů (kolorektální karcinom: CRC), kteří byli odesláni do nemocnice Imama Chomejního v Teheránu v období od března 2015 do ledna 2017, byli vybráni k účasti v této studii. Etická komise Teheránské univerzity lékařských věd schválila protokol studie. Od všech účastníků byl rovněž získán informovaný souhlas. Všichni pacienti byli diagnostikováni na základě klinických příznaků a histologických a radiografických standardů, které vykazovaly typické znaky se zvláštním rozložením (Swiderska et al., 2014). Veškeré údaje o věku, pohlaví a typu lézí byly získány z dokumentace pacientů. Všichni pacienti, kteří vstupují do studie, byli diagnostikováni v době kolonoskopie a chemoterapie nebyla zahájena pro jejich léčbu.
Ve stejném období bylo do studie zařazeno 52 zdravých kontrol, bez osobní nebo rodinné anamnézy diagnostikovaného kolorektálního onemocnění, jejichž věk a pohlaví odpovídaly věku a pohlaví pacientů, jako kontroly. Vylučujícím kritériem pro kontroly byla nedávná anamnéza průjmu a IBD. Žádný z jedinců, kteří se zúčastnili této studie, neužíval v posledních 3 měsících antibiotika ani probiotika. Všechny vzorky byly uchovávány ve sterilní nádobě obsahující thioglykolátové médium (Merck, Německo) a do laboratoře byly převezeny v anaerobním stavu k okamžitému zpracování. Od každého pacienta byly také odebrány 2 slizniční biopsie pro kultivaci a extrakci DNA.
Bakteriální kultivace
Pro mechanické narušení a homogenizaci všech biopsií byly použity dva skleněné homogenizátory; poté byly kultivovány na agaru Bacteroides Bile Esculin (BBE) (Himedia Laboratories Pvt. Ltd, Indie). V této studii byl použit systém Anoxomat (MART Microbiology Drachten, Nizozemsko) k zajištění plynných atmosférických podmínek pro anaeroby; poté byly destičky inkubovány v anaerobní komoře při 37 °C po dobu 72 h. Kromě toho byl B. fragilis potvrzen pomocí metody PCR v reálném čase.
Extrakce DNA
DNA byla extrahována přímo z bioptické tkáně pomocí soupravy RTP® Mycobacteria Kit (Invitek, Berlin, Německo). Optická hustota (OD) extrahované DNA byla stanovena při 260 nanometrech. Poté byla DNA uchována při -20 °C pro následnou analýzu a PCR v reálném čase.
PCR v reálném čase
Sekvence genu bft a 16S rRNA byly znovu získány z Genové banky. Primery a sondy byly navrženy pomocí primeru 3 plus (http://www.bioinformatics.nl/cgi-bin/primer3plus/primer3plus.cgi). Všechny primery a sondy použité pro detekci všech typů genu bft byly navrženy v naší předchozí studii (Zamani et al., 2017). Za účelem detekce podtypů genu bft byla provedena PCR v reálném čase, jak bylo popsáno dříve (Merino et al., 2011).
Jako pozitivní kontroly byly použity genomická DNA kmene ETBF D-134 a klon 1 RIGLD (Rashidan et al., 2018). Negativní kontrolou byla PCR TaqMan master mix s destilovanou vodou místo DNA.
Pro amplifikaci byla připravena standardní DNA a počet molekul templátu na gram byl vypočten podle definovaného vzorce (Zamani et al., 2017). Standardní křivka pro bft a gen 16S rRNA byla vyhodnocena pomocí každého primeru a sondy s desetinásobným sériovým ředěním vzorků DNA B. fragilis, což odpovídá 101-106 průměrným hodnotám na gram biopsie.
Podle standardní křivky a y-interceptu byly vzorky, které nevykazovaly fluorescenční signál dříve než Ct 38, určeny jako negativní. Rovněž vzorky, které vykazovaly fluorescenci o hodnotě Ct ≤ 10, byly zředěny. Účinnost PCR v reálném čase byla stanovena jako E = 10(-1/slop) – 1 (Zamani et al., 2017).
Po optimalizaci standardních křivek byla do každého amplifikačního běhu vložena řada ředění. Testy PCR v reálném čase byly vyhodnoceny pomocí nástroje LinGene K Real Time PCR (Bioer, Hangzhou, PR, Čína). Všechny testy byly provedeny v objemu 25 μl (Zamani et al., 2017). Pro zajištění kvality byly všechny experimenty podruhé nezávisle na sobě zopakovány a byly uvedeny průměry.
Pro kontrolu specifičnosti PCR a očekávané velikosti produktu byly primery použity v konvenční PCR a amplikony byly spuštěny na agarózovém gelu. Kromě toho byla specifita pozitivně amplifikovaných fragmentů prokázána sekvenováním. Produkt PCR byl zaslán jihokorejské společnosti Macrogen Corporation k sekvenování. Výsledky sekvenování byly analyzovány pomocí softwaru Chromas 2.6. Poté byly všechny sekvence zařazeny do databáze NCBI (https://blast.ncbi.nlm.nih.gov/Blast.cgi). U všech sekvenovaných izolátů bylo procento podobnosti s příbuznými geny (gen 16s rRNA a gen bft) přítomnými v databázi NCBI vyšší než 95 %.
Statistická analýza
Výsledky byly porovnány pomocí Fisherova přesného, Chi square a Mannova-Whitneyho testu. P < 0,05 bylo považováno za statisticky významné. Pro B. fragilis a ETBF byly rovněž vypočteny průměrné hodnoty ± Std. chyba průměru (SEM). Data byla analyzována pomocí statistického softwaru SPSS 13.0.
V této studii byla použita podmíněná logistická regrese k vyhodnocení poměrů šancí (OR) a 95% intervalů spolehlivosti. V tomto designu je poměr šancí konzistentním odhadem poměru míry výskytu CRC při expozici ETBF oproti neexponovaným subjektům.
Výsledky
V této studii bylo odebráno 68 vzorků od pacientů s CRC (36 mužů a 32 žen; průměrný věk: 55 let; rozmezí: 35-78) a 52 vzorků od zdravých kontrol (HC) (30 mužů a 22 žen; průměrný věk: 56 let; rozmezí: 42-78). Všichni pacienti byli diagnostikováni na základě kolonoskopických výkonů v době odběru vzorků. Všichni pacienti diagnostikovaní v době kolonoskopie dávají celkem 26 pacientů s invazivním CRC, 18 pacientů se serózními lézemi, 24 pacientů s adenomem zahrnuje 14 pacientů s LGD a 10 pacientů s HGD podle současné klasifikace (obr. 1). Tyto biopsie byly odebrány z pravé strany (vzestupné), z levé strany (sestupné) a z obou stran u 22, 32 a 14 pacientů (tabulka 1).
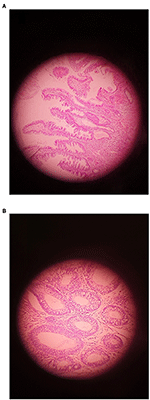
Obrázek 1. Příklad adenomu znázorňující (A) LGD a (B) HGD (původní zvětšení ×400).
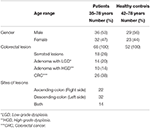
Tabulka 1. Charakteristika pacientů a HC.
Výsledky kultivace B. fragilis byly pozitivní u 31(51 %), resp. 25 (48 %) vzorků pacientů a zdravých kontrol (tabulka 2) (P = 0,7).

Tabulka 2. Výsledky kultivace B. fragilis. Údaje o kultuře Bacteroides fragilis.
Podle standardní křivky poskytla ředění DNA ETBF (kontrola pozitivní) při 101, 102, 103, 104, 105 a 106 hodnoty Ct 15,08 ± 0,1, 18,04 ± 0,2, 21,42 ± 0,2, 25,02 ± 0,2, 28,02 ± 0,4 a 31,96 ± 0,4, v tomto pořadí. Účinnost PCR v reálném čase se pohybovala mezi 98 a 100 %.
Pozitivních vzorků pro gen 16S rRNA a gen bft bylo u pacientů 63 a 47 %. Pozitivní výsledky však byly prokázány u 81 a 3,8 % vzorků HC (tabulka 3). Rozdíl mezi pozitivitou genu bft u pacientů a HC byl statisticky významný (P = 0,00).
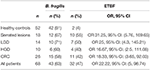
Tabulka 3. Počet vzorků pozitivních na gen 16S rRNA a geny bft v klinicko-patologických skupinách a HC.
Také počet vzorků pozitivních na geny bft u CRC a HC v rámci klinicko-patologických skupin je uveden v tabulce 3. Nejvyšší OR byl zjištěn ve skupině se serózními lézemi následované skupinou s adenomatózními lézemi s LGD. Také OR pro všechny pacienty (OR 22,22, 95% CI: 5, 98,74) popisuje souvislost ETBF a existence lézí.
Výsledky kvantitativní analýzy PCR v reálném čase pro 16S rRNA gen počítaný pro B. fragilis a bft gen počítaný pro ETBF na ng DNA jsou uvedeny v tabulce č. 4. Rozdíl mezi počtem kopií genu 16S rRNA u pacientů a HC nebyl statisticky významný (P ≥ 0,05). Počet kopií genu bft byl vyšší ve vzorcích pacientů než ve vzorcích zdravých kontrol (P = 0,00). Kromě toho byl počet kopií genu bft vyšší u ETBF pozitivních vzorků ve skupině s prekurzorovými lézemi ve srovnání se vzorky s CRC; tento rozdíl však nebyl statisticky významný. Výsledky sekvenování potvrdily přítomnost genů bft a 16S rRNA (datový list 1).
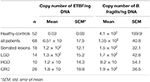
Tabulka 4. Kvantitativní analýza genu 16S rRNA a genů bft v klinickopatologických skupinách a HC.
Výsledky těchto vzorků navíc ukázaly, že nejčastějším podtypem genu bft byl bft1 následovaný bft2. Z 32 izolátů nesoucích gen bft bylo 18 (56,2 %) izolátů subtypizováno jako bft-1 a 14 (43,7 %) izolátů jako bft-2. Na základě těchto výsledků bylo zjištěno, že se jedná o izoláty s genem bft. Kromě toho byl gen bft detekován u 2 vzorků HC a všechny byly subtypovány jako bft-1. Žádný vzorek DNA nenesl podtyp bft-3.
Diskuse
Roste počet důkazů o vlivu mikrobiální dysbiózy ve střevě, iniciaci a rozvoji kolorektálního karcinomu (Sears a Garrett, 2014; Gagniere et al., 2016). Ačkoli byl v Íránu zaznamenán nižší výskyt CRC ve srovnání s jinými zeměmi, předpokládá se, že se jeho míra v budoucnu zvýší (Hosseini et al., 2004; Malekzadeh et al., 2009). V předchozích studiích se také uvádělo, že ETBF může hrát roli při průjmech a IBD (Myers et al., 1987; Prindiville et al., 2000; Basset et al., 2004; Merino et al., 2011; Purcell et al., 2017; Zamani et al.,
Některá šetření naznačují, že některé bakteriální druhy (např. ETBF) mohou působit jako patogenní bakterie, které objasňují rozvoj dysbiózy v mikrobiálním společenství střeva a spouštějí CRC (Hajishengallis et al., 2012; Hajishengallis a Lamont, 2016). Kolorektální tumorigeneze byla vyvolána imunitní reakcí a aktivací prozánětlivých cytokinů v důsledku BFT (Wu et al., 2004, 2009).
Zjištění této studie ukázala, že ETBF byla významně spojena se zubatými lézemi, po nichž následovala LGD. Vyšší poměr šancí u těchto lézí také ukázal, že expozice ETBF je rizikovým faktorem pro nádorové a zejména prekancerózní stavy. To podporuje hypotézu, že kmeny produkující BFT mohou hrát důležitou roli při spouštění zánětu a imunologické odpovědi u geneticky vnímavých osob a mohou vést ke vzniku CRC. První studii prokazující zvýšený výskyt ETBF ve vzorcích stolice pacientů s kolorektálním karcinomem (38 %) ve srovnání s kontrolní skupinou (12 %) provedli Ulger Toprak et al (2006). Některé předchozí zprávy navíc prokázaly souvislost mezi genem bft a CRC, zejména v pozdním stadiu CRC (Dejea et al., 2014; Boleij et al., 2015; Viljoen et al., 2015). Studie provedená Purcellem et al. prokázala významné asociace ETBF s tubulárními adenomy, serrated lézemi a low-grade dysplazií, což bylo podobné výsledkům této studie (Purcell et al., 2017).
V této studii vykazovaly prekurzorové léze, včetně těch s low-grade dysplazií, rostoucí trend v množství genu bft ve srovnání s lézemi s CRC; tento rozdíl však nebyl statisticky významný. Autoři navíc již dříve uvedli, že markery ETBF byly pozorovány v tlustém střevě a terminálním ileu pacientů s ulcerózní kolitidou, kteří mají predispozici k CRC (Zamani et al., 2017; Rashidan et al., 2018). Podobně v předchozí studii byl zjištěn pouze podtyp bft1 tohoto genu (Zamani et al., 2017). Ačkoli byl gen bft1 nejčastějším podtypem, v této studii byl nalezen také gen bft2.
V této studii byl ETBF detekován v lézích pacientů s CRC a podobné výsledky již dříve uvedli také další badatelé, kteří studovali ETBF ve vzorcích sliznice tlustého střeva (Boleij et al., 2015; Viljoen et al., 2015). Nedávné studie o úloze střevního mikrobiomu prokázaly, že dysbióza mikrobiálního společenstva se vyskytuje v nenádorových i nádorových oblastech pacientů s CRC (Dejea et al., 2014; Flemer et al., 2017; Purcell et al., 2017). V těchto studiích se ukázalo, že některé z bakterií včetně Fusobacterium nucleatum, ETBF, Escherichia coli, Streptococcus gallolyticus a Enterococcus faecalis a bakterií produkujících butyrát mohou hrát důležitou roli při vzniku CRC (Dejea et al., 2014; Flemer et al., 2017; Park et al., 2018).
Výsledky PCR v reálném čase pro detekci B. fragilis ukázaly, že větší procento pacientů a HC obsahovalo B. fragilis ve srovnání s kultivační metodou. Zlatým standardem pro detekci bakterií je kultivační metoda, která však vyžaduje vysoký počet životaschopných buněk a konkrétně u kultivace anaerobních bakterií by mohlo dojít k určitým omezením. Může být, že tato omezení ovlivňují rozdíl mezi výsledky.
Rozdíly v kultivaci B. fragilis a výsledcích Real-time PCR mezi kontrolami a vzorky CRC nejsou významné. Tyto údaje naznačují, že v této studii mohly k CRC pravděpodobně přispívat kmeny, které jsou nositeli genu bft, nikoliv samotný B. fragilis. Bylo prokázáno, že B. fragilis je významným lidským komenzálem, takže tato bakterie může být izolována i ze zdravých kontrol stejně jako u pacientů. Ale u pacientů s nádorovými a prekancerózními lézemi se zvýšil počet některých kmenů, které obsahují geny bft, a tato dysbióza pravděpodobně může vyvolat zánět. Některé studie navíc ukázaly, že lidská komenzální B. fragilis zabránila rozvoji kolitidy a může poskytnout účinnou terapeutickou strategii pro CRC, zatímco různé studie naznačují, že enterotoxigenní kmeny této bakterie jsou spojeny se střevními nádory v důsledku produkce enterotoxinů (Sears et al., 1995, 2014; Mazmanian et al., 2008; Lee et al., 2018).
V této studii byla určitá omezení. K diagnostice genu bft, který byl získán přímo z nádorové tkáně v tlustém střevě pacientů, byly použity různé metody. Proto se doporučuje provést rozsáhlou populační kohortovou studii. Kromě toho je třeba provést další šetření, aby se prokázala možná souvislost mezi přítomností genu bft a serózními lézemi, LGD a CRC.
Závěry
Výsledky této studie naznačují, že ETBF by mohl být kromě pacientů s CRC přítomen i ve slizničních biopsiích pacientů s prekancerózami, jako jsou serózní léze a LGD. Byla zjištěna významná souvislost mezi přítomností ETBF v postižených tkáních a počtem těchto bakterií ve vzorcích pacientů, zejména u prekancerózních karcinogenních lézí: adenomů s low-grade dysplazií a serrated lézí. Ve skutečnosti je ETBF častěji detekována v časných lézích, ale k přesnému určení se zdá být užitečný další výzkum s větším počtem vzorků.
Také je nutný další výzkum, aby se zjistilo, zda věk, pohlaví, strava a další faktory prostředí ovlivňují diagnostiku ETBF u lidí v průběhu času.
Nakonec by ETBF mohla být markerem prognózy CRC, zejména v prekancerózních lézích, a mohla by být použita ke screeningu těchto onemocnění.
Prohlášení o dostupnosti údajů
Zpracované údaje podporující závěry tohoto rukopisu budou autory bez zbytečných výhrad poskytnuty každému kvalifikovanému výzkumníkovi.
Etické prohlášení
Studie zahrnující lidské účastníky byly posouzeny a schváleny etickou komisí Teheránské univerzity lékařských věd. Pacienti/účastníci poskytli svůj písemný informovaný souhlas s účastí v této studii.
Příspěvky autorů
SZ je prvním autorem, který provedl všechny laboratorní experimenty, shromáždil a analyzoval data a vypracoval rukopis. RT je gastroenterolog, který provedl kolonoskopii a poskytl vzorky ze všech případů. LS se podílel na návrhu a koordinaci studie a radil ve všech jejích částech. AS a SJ se podíleli na sběru vzorků a provádění testů. MF dohlížela na všechny části studie. Všichni autoři si přečetli a schválili rukopis.
Financování
Tato práce byla podpořena Teheránskou univerzitou lékařských věd (grant č.: 32467).
Konflikt zájmů
Autoři prohlašují, že výzkum byl prováděn bez jakýchkoli komerčních nebo finančních vztahů, které by mohly být chápány jako potenciální konflikt zájmů.
Poděkování
Autoři by rádi poděkovali personálu nemocnice Imáma Chomejního za laskavou podporu při sběru vzorků.
Doplňkový materiál
Doplňkový materiál k tomuto článku lze nalézt online na adrese: https://www.frontiersin.org/articles/10.3389/fcimb.2019.00449/full#supplementary-material
Data Sheet 1. Výsledky sekvenování genů bft a 16S rRNA u jednoho izolátu.
Basset, C., Holton, J., Bazeos, A., Vaira, D., and Bloom, S. (2004). Podílejí se Helicobacter species a enterotoxigenní Bacteroides fragilis na in?amatorních střevních onemocněních? Dig. Dis. Sci. 49, 1425-1432. doi: 10.1023/B:DDAS.0000042241.13489.88
CrossRef Full Text | Google Scholar
Boleij, A., Hechenbleikner, E. M., Goodwin, A. C., Badani, R., Stein, E. M., Lazarev, M. G., et al. (2015). Gen pro toxin Bacteroides fragilis je rozšířen ve sliznici tlustého střeva pacientů s kolorektálním karcinomem. Clin. Infect. Dis. 60, 208-215. doi: 10.1093/cid/ciu787
PubMed Abstract | CrossRef Full Text | Google Scholar
Boyle, P., and Langman, J. (2000). ABC kolorektálního karcinomu: epidemiologie. BMJ 321, 805-808. doi: 10.1136/bmj.321.7264.805
PubMed Abstract | CrossRef Full Text | Google Scholar
Dejea, C. M., Wick, E. C., Hechenbleikner, E. M., White, J. R., Mark Welch, J. L., Rossetti, B. J., et al. (2014). Organizace mikrobioty je odlišným rysem proximálních kolorektálních karcinomů. Proc. Natl. Acad. Sci. U.S.A. 111, 18321-18326. doi: 10.1073/pnas.1406199111
PubMed Abstract | CrossRef Full Text | Google Scholar
Ferlay, J., Soerjomataram, I., Dikshit, R., Eser, S., Mathers, C., Rebelo, M., et al. (2015). Incidence a úmrtnost na rakovinu ve světě: zdroje, metody a hlavní vzorce v GLOBOCAN 2012. Int. J. Cancer 136, E359-E386. doi: 10.1002/ijc.29210
PubMed Abstract | CrossRef Full Text | Google Scholar
Flemer, B., Lynch, D. B., Brown, J. M., Jeffery, I. B., Ryan, F. J., Claesson, M. J., et al. (2017). Nádorově asociovaná a nenádorově asociovaná mikrobiota u kolorektálního karcinomu. Gut 66, 633-643. doi: 10.1136/gutjnl-2015-309595
PubMed Abstract | CrossRef Full Text | Google Scholar
Gagniere, J., Raisch, J., Veziant, J., Barnich, N., Bonnet, R., Buc, E., et al. (2016). Nerovnováha střevní mikrobioty a kolorektální karcinom. World J. Gastroenterol. 22, 501-518. doi: 10.3748/wjg.v22.i2.501
PubMed Abstract | CrossRef Full Text | Google Scholar
Hajishengallis, G., Darveau, R. P., and Curtis, M. A. (2012). Hypotéza klíčového patogenu. Nat. Rev. Microbiol. 10, 717-725. doi: 10.1038/nrmicro2873
PubMed Abstract | CrossRef Full Text | Google Scholar
Hajishengallis, G., and Lamont, R. J. (2016). Tanec s hvězdami: jak choreografické bakteriální interakce diktují nososymbiocitu a dávají vzniknout klíčovým patogenům, akcesorním patogenům a patobiontům. Trends Microbiol. 24, 477-489. doi: 10.1016/j.tim.2016.02.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Hosseini, S. V., Izadpanah, A., and Yarmohammadi, H. (2004). Epidemiologické změny kolorektálního karcinomu v íránském městě Shiraz: 1980-2000. ANZ J. Surg. 74, 547-549. doi: 10.1111/j.1445-2197.2004.03064.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Johnson, C. M., Wei, C., Ensor, J. E., Smolenski, D. J., Amos, C. I., Levin, B., et al. (2013). Metaanalýzy rizikových faktorů kolorektálního karcinomu. Cancer Causes Control. 24:120722. doi: 10.1007/s10552-013-0201-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Kolahdoozan, S., Sadjadi, A., Radmard, A. R., and Khademi, H. (2010). Pět nejčastějších druhů rakoviny v Íránu. Arch. Iran Med. 13, 143-146.
PubMed Abstract | Google Scholar
Lee, Y. K., Mehrabian, P., Boyajian, S., Wu, W. L., Selicha, J., Vonderfecht, S., et al. (2018). The protective role of bacteroides fragilis in a murine model of colitis-associated colorectal cancer. mSphere. 3:e00587-e00518. doi: 10.1128/mSphere.00587-18
PubMed Abstract | CrossRef Full Text | Google Scholar
Malekzadeh, R., Bishehsari, F., Mahdavinia, M., and Ansari, R. (2009). Epidemiologie a molekulární genetika kolorektálního karcinomu v Íránu: přehled. Arch. Iran Med. 12:161-169.
PubMed Abstract | Google Scholar
Mazmanian, S. K., Round, J. L., and Kasper, D. L. (2008). Faktor mikrobiální symbiózy zabraňuje střevním zánětlivým onemocněním. Nature. 453, 620-625. doi: 10.1038/nature07008
PubMed Abstract | CrossRef Full Text | Google Scholar
Merino, V. R., Nakano, V., Liu, C., Song, Y., Finegold, S. M., and Avila-Campos, M. J. (2011). Kvantitativní detekce enterotoxigenních podtypů Bacteroides fragilis izolovaných od dětí s průjmem a bez průjmu. J. Clin. Microbiol. 49, 416-418. doi: 10.1128/JCM.01556-10
PubMed Abstract | CrossRef Full Text | Google Scholar
Moghimi-Dehkordi, B., Safaee, A., and Zali, M. (2008). Prognostické faktory u 1138 íránských pacientů s kolorektálním karcinomem. Int. J. Colorect. Dis. 23, 683-688. doi: 10.1007/s00384-008-0463-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Myers, L. L., Shoop, D. S., Stackhouse, L. L., Newman, F. S., Flaherty, R. J., Letson, G. W., et al. (1987). Isolation of enterotoxigenic Bacteroides fragilis from humans with diarrhoea. J. Clin. Microbiol. 25, 2230-2233.
Google Scholar
Park, C. H., Eun, C. S., and Han, D. S. (2018). Střevní mikrobiota, chronický zánět a kolorektální karcinom. Intest. Res. 16:338. doi: 10.5217/ir.2018.16.3.338
PubMed Abstract | CrossRef Full Text | Google Scholar
Prindiville, T., Sheikh, R., Cohen, S., Tang, Y., Cantrell, M., and Silva, J. (2000). Sekvence genu pro enterotoxin Bacteroides fragilis u pacientů s intimním onemocněním střev. Emerg. Infect. Dis. 6, 171-174. doi: 10.3201/eid0602.000210
CrossRef Full Text | Google Scholar
Purcell, R. V., Pearson, J., Aitchison, A., Dixon, L., Frizelle, F. A., and Keenan, J. I. (2017). Kolonizace enterotoxigenním Bacteroides fragilis je spojena s časným stadiem kolorektální neoplazie. PLoS ONE 12:e0171602. doi: 10.1371/journal.pone.0171602
PubMed Abstract | CrossRef Full Text | Google Scholar
Rafiemanesh, H., Pakzad, R., Abedi, M., Kor, Y., Moludi, J., Towhidi, F., et al. (2016). Kolorektální karcinom v Íránu: epidemiologie a morfologické trendy. EXCLI J. 15, 738-744. doi: 10.17179/2Fexcli2016-346
PubMed Abstract | CrossRef Full Text | Google Scholar
Rashidan, M., Azimirad, M., Alebouyeh, M., Ghobakhlou, M., Aghdaei, H. A., and Zali, M. R. (2018). Detekce skupiny B. fragilis a diverzity enterotoxinu bft a markerů antibiotické rezistence cepA, cfiA a nim mezi střevními kmeny Bacteroides fragilis u pacientů se zánětlivým střevním onemocněním. Anaerobe 50, 93-100. doi: 10.1016/j.anaerobe.2018.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Sears, C. L., and Garrett, W. S. (2014). Mikrobi, mikrobiota a rakovina tlustého střeva. Cell Host Microbe 15, 317-328. doi: 10.1016/j.chom.2014.02.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Sears, C. L., Geis, A. L., and Housseau, F. (2014). Bacteroides fragilis rozvrací biologii sliznice: od symbionta ke karcinogenezi tlustého střeva. J. Clin. Invest. 124, 4166-4172. doi: 10.1172/JCI72334
PubMed Abstract | CrossRef Full Text | Google Scholar
Sears, C. L., Myers, L. L., Lozenby, A., and Van Tassel, R. L. (1995). Enterotoxigenní Bacteroides fragilis. Clin Infect Dis. 20(suppl):142-148. doi: 10.1093/clinids/20.Supplement_2.S142
CrossRef Full Text | Google Scholar
Siegel, R., DeSantis, C., and Jemal, A. (2014). Statistiky kolorektálního karcinomu, 2014. Cancer J. Clinic. 64, 104-117. doi: 10.3322/caac.21220
PubMed Abstract | CrossRef Full Text | Google Scholar
Swiderska, M., Choromanska, B., Dabrowska, E., Konarzewska-Duchnowska, E., Choromanska, K., Szczurko, G., et al. (2014). Diagnostika kolorektálního karcinomu. Contempor Oncol. 18, 1-6. doi: 10.5114/wo.2013.39995
PubMed Abstract | CrossRef Full Text | Google Scholar
Ulger Toprak, N., Yagci, A., Gulluoglu, B. M., Akin, M. L., Demirkalem, P., Celenk, T., et al. (2006). Možná role enterotoxinu Bacteroides fragilis v etiologii kolorektálního karcinomu. Clin. Microbiol. Infect. 12, 782-786. doi: 10.1111/j.1469-0691.2006.01494.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Viljoen, K. S., Dakshinamurthy, A., Goldberg, P., and Blackburn, J. M. (2015). Quantitative profiling of colorectal cancerassociated bacteria reveals associations between fusobacterium spp., enterotoxigenic Bacteroides fragilis (ETBF) and clinicopathological features of colorectal cancer. PLoS ONE 10:e0119462. doi: 10.1371/journal.pone.0119462
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, S., Lim, K. C., Huang, J., Saidi, R. F., and Sears, C. L. (1998). Bacteroides fragilis enterotoxin štěpí zonální adherenční protein E-cadherin. Proc. Natl. Acad. Sci. U.S.A. 95, 14979-14984. doi: 10.1073/pnas.95.25.14979
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, S., Morin, P. J., Mauyo, D. J. I. K., and Sears, C. (2003). Enterotoxin Bacteroides fragilis indukuje expresi c-myc a buněčnou proliferaci. Gastroenterology 124, 392-400. doi: 10.1053/gast.2003.50047
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, S., Powell, J., Mathioudakis, N., Kane, S., Fernandez, E., and Sears, C. L. (2004). Bacteroides fragilis enterotoxin indukuje sekreci interleukinu-8 střevními epiteliálními buňkami prostřednictvím mitogenem aktivovaných proteinových kináz a tyrozinkinázou regulované dráhy nukleárního faktoru-kappaB. Infect. Immun. 72, 5832-5839. doi: 10.1128/IAI.72.10.5832-5839.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, S., Rhee, K. J., Albesiano, E., Rabizadeh, S., Wu, X., Yen, H. R., et al. (2009). Lidský komenzál tlustého střeva podporuje tumorigenezi tlustého střeva prostřednictvím aktivace odpovědí T buněk pomocníka typu 17. Nat. Med. 15, 1016-1022. doi: 10.1038/nm.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Zamani, S., Shariati, S. H., Zali, M. R., Aghdaei, H. A., Asiabar, A. S., Bokaie, S., et al. (2017). Detekce enterotoxigenního Bacteroides fragilis u pacientů s ulcerózní kolitidou. Gut Pathogens 9:53. doi: 10.1186/s13099-017-0202-0
PubMed Abstract | CrossRef Full Text | Google Scholar
.