Frontiers in Cellularand Infection Microbiology
Introduction
Bacteroides fragilis, który występuje we florze przewodu pokarmowego ludzi i zwierząt gospodarskich, jest bakterią beztlenową. Jest jednym z wybitnych komensali człowieka i jednym z najczęściej izolowanych Bacteroides z próbek klinicznych, który powoduje biegunkę, zapalenie otrzewnej, ropnie wewnątrzbrzuszne, sepsę i endogenne zakażenia ropne (Sears i in., 1995, 2014).
Wykazano, że B. fragilis zapobiega chorobom zapalnym jelit u zwierząt z zapaleniem jelita grubego dzięki produkcji immunomodulującej cząsteczki polisacharydu A (PSA), która indukuje przeciwzapalną odpowiedź immunologiczną w tkance jelitowej (Mazmanian i in., 2008; Lee i in., 2018). Za patogenność B. fragilis odpowiada kilka czynników, w tym kapsułka, białka błony zewnętrznej (OMPs) oraz specjalne enzymy, które składają się na metaloproteazę o masie 20 kDa określaną jako toksyna Bacteroides fragilis (BFT) (Sears i in., 1995, 2014).
BFT-produkująca B. fragilis, enterotoksyczna B. fragilis (ETBF), została poznana jako przyczyna zaburzeń biegunkowych u ludzi i zwierząt (Myers i wsp., 1987; Purcell i wsp., 2017). ETBF jest znany jako czynnik ryzyka nieswoistych chorób zapalnych jelit (IBD) i jest obecny w stolcu i próbkach biopsyjnych pacjentów (Prindiville i wsp., 2000; Basset i wsp., 2004; Zamani i wsp., 2017). Ekspresja BFT ujawnia się w celu rozszczepienia zewnątrzkomórkowej domeny E-kadheryny, która jest głównym składnikiem strukturalnym zonuli adherens i odpowiada za adhezję komórek. Ponadto, BFT może aktywować sygnalizację B-kateniny i indukować wydzielanie IL8 w komórkach nabłonka jelita grubego (Wu i in., 1998). W jednym z badań wykazano, że po potraktowaniu komórek HT29/C1 BFT, utrata związanej z błoną E-kadheryny inicjuje jądrową lokalizację ß-kateniny, która indukuje translację c-myc i prowadzi do trwałej proliferacji komórek (Wu i in., 2003). Siła działania BFT oraz jej wpływ na strukturę i fizjologię nabłonka przewodu pokarmowego sugerują, że obecność ETBF może przyczyniać się do rozwoju przewlekłych chorób jelita grubego, w tym transformacji onkogennej, zapalenia jelit, przewlekłych dysfunkcji jelita grubego oraz zmian przedrakowych i nowotworowych jelita grubego (Wu i in., 1998, 2003; Sears et al., 2014).
Rak jelita grubego (CRC) jest jednym z najczęściej występujących nowotworów na świecie i obejmuje 9% wszystkich nowotworów i jest czwartą przyczyną zgonów związanych z rakiem na świecie (Sears et al., 1995; Ferlay et al., 2015). Istnieje jednak znaczna różnica między krajami w standaryzowanej względem wieku zapadalności na ten nowotwór; zapadalność w USA i krajach europejskich jest ponad 25-krotnie wyższa niż w krajach afrykańskich i azjatyckich. Zachorowalność i śmiertelność z powodu CRC zmniejsza się w ostatnich latach ze względu na udoskonalone testy przesiewowe, które mogą wykryć modyfikacje jelita grubego na wcześniejszych etapach oraz poprawę w zakresie leków i procedur (Boyle i Langman, 2000; Rafiemanesh i in., 2016).
CRC jest jednym z najczęstszych nowotworów w Iranie i jest trzecim najczęściej występującym nowotworem wśród irańskich mężczyzn (8,1-8,3 na 100 000 populacji) i czwartym najczęściej występującym nowotworem wśród irańskich kobiet (6,5-7,5 na 100 000 populacji) (Moghimi-Dehkordi et al., 2008; Kolahdoozan et al., 2010). Czynnikami ryzyka CRC są otyłość, siedzący tryb życia, dieta wysokotłuszczowa, uboga w warzywa i owoce, palenie tytoniu, nadużywanie alkoholu oraz stosowanie niesteroidowych leków przeciwzapalnych (NSAIDs). Przewlekły stan zapalny, IBD, polipy, gruczolaki i dysplazja powodują zmiany w komórkach jelita grubego i czynią je podatnymi na nowotwory (Boyle i Langman, 2000; Johnson i in., 2013).
Zachorowalność i umieralność na CRC zmniejsza się w rozwiniętych krajach zachodnich, podczas gdy jej częstość wzrasta wśród obu płci w ciągu ostatnich dziesięcioleci w Iranie z powodu zmian stylu życia i diety. Inną przyczyną tego spadku może być wzrost liczby placówek oraz poprawa wyposażenia i technologii, ponieważ więcej osób kieruje się do placówek służby zdrowia na badania przesiewowe, podczas gdy w przeszłości dana osoba mogła mieć nowotwór, a nawet umrzeć, ale nowotwór pozostał niezdiagnozowany z powodu braku wyposażenia i placówek (Malekzadeh i in., 2009; Siegel i in., 2014).
W tym badaniu, częstość i obfitość ETBF w próbkach biopsyjnych pacjentów z CRC i stanami przedrakowymi porównano z tymi u osób bez osobistej lub rodzinnej historii choroby jelita grubego, aby zbadać związek między obecnością BFT a rozwojem guza.
Materiały i Metody
Pacjenci i Okazy
W tym badaniu kontrolnym, 120 biopsji śluzówki zostało pobranych od irańskich pacjentów ze stanem przedrakowym i CRC (n = 68) i grupy kontrolnej (n = 52) przy użyciu kolonoskopii. Pacjenci ze stanem przedrakowym (Serrated lesions, Adenoma include Low-grade Dysplasia: LGD i dysplazja dużego stopnia: HGD) i rakiem (Colorectal Cancer: CRC), którzy zgłosili się do szpitala Imam Khomeini w Teheranie między marcem 2015 a styczniem 2017 roku, zostali wybrani do udziału w tym badaniu. Komisja Etyki Uniwersytetu Medycznego w Teheranie zatwierdziła protokół badania. Uzyskano również świadomą zgodę od wszystkich uczestników. Wszyscy pacjenci zostali zdiagnozowani na podstawie objawów klinicznych, a także standardów histologicznych i radiograficznych, które wykazały typowe cechy ze specjalną dystrybucją (Swiderska i in., 2014). Wszystkie dane dotyczące wieku, płci oraz rodzaju zmian chorobowych zostały pobrane z dokumentacji pacjentów. Wszyscy pacjenci, którzy wchodzą do badania zdiagnozowani w czasie kolonoskopii i chemioterapia nie rozpoczęła się dla ich leczenia.
W tym samym okresie, 52 zdrowe kontrole, bez osobistej lub rodzinnej historii diagnostycznej choroby jelita grubego, których wiek i płeć pasowały do tych z pacjentów zostały włączone do badania jako kontrole. Niedawna biegunka i IBD w wywiadzie stanowiły kryterium wykluczenia z badania. Żadna z osób biorących udział w badaniu nie stosowała antybiotyków ani probiotyków w ciągu ostatnich 3 miesięcy. Wszystkie próbki były przechowywane w sterylnym pojemniku zawierającym podłoże tioglikolanowe (Merck, Niemcy) i transportowane do laboratorium w warunkach beztlenowych w celu natychmiastowej obróbki. Od każdego pacjenta pobrano również 2 biopsje błony śluzowej do hodowli i ekstrakcji DNA.
Kultura bakteryjna
Dwa szklane homogenizatory zostały użyte do mechanicznego rozbicia i homogenizacji wszystkich biopsji; następnie były one hodowane na podłożu Bacteroides Bile Esculin agar (BBE) (Himedia Laboratories Pvt. Ltd, Indie). W tym badaniu użyto systemu Anoxomat (MART Microbiology Drachten, Holandia), aby zapewnić gazowe warunki atmosferyczne dla beztlenowców; następnie płytki inkubowano w komorze beztlenowej w temperaturze 37°C przez 72 h. Ponadto potwierdzono obecność B. fragilis metodą real-time PCR.
Ekstrakcja DNA
DNA ekstrahowano bezpośrednio z tkanki biopsyjnej przy użyciu zestawu RTP® Mycobacteria Kit (Invitek, Berlin, Niemcy). Gęstość optyczną (OD) wyekstrahowanego DNA oznaczano przy 260 nanometrach. Następnie DNA konserwowano w temperaturze -20°C do dalszych analiz i real-time PCR.
Real-Time PCR
Sekwencje genu bft i 16S rRNA odzyskano z banku genów. Startery i sondy zostały zaprojektowane przy użyciu primera 3 plus (http://www.bioinformatics.nl/cgi-bin/primer3plus/primer3plus.cgi). Wszystkie startery i sondy użyte do wykrywania wszystkich typów genów bft zostały zaprojektowane w naszym poprzednim badaniu (Zamani i in., 2017). W celu wykrycia podtypów genu bft przeprowadzono PCR w czasie rzeczywistym, jak wcześniej opisano (Merino i in., 2011).
Genomowe DNA szczepu ETBF D-134 i klonu RIGLD 1 wykorzystano jako kontrole pozytywne (Rashidan i in., 2018). Kontrolę negatywną stanowił PCR TaqMan master mix z wodą destylowaną zamiast DNA.
Standardowe DNA przygotowano do amplifikacji, a liczbę cząsteczek szablonu na gram obliczono według zdefiniowanego wzoru (Zamani i in., 2017). Krzywa standardowa dla bft i genu 16S rRNA została oceniona przy użyciu każdego startera i sondy z 10-krotnym seryjnym rozcieńczeniem próbek DNA B. fragilis, odpowiadającym 101-106 średniej wartości na gram biopsji.
Zgodnie z krzywą standardową i y-interceptem, próbki, które nie wykazywały sygnału fluorescencyjnego wcześniej niż Ct równe 38, zostały określone jako negatywne. Również próbki, które wytwarzały fluorescencję o wartości Ct ≤ 10, były rozcieńczane. Skuteczność real-time PCR określono jako E = 10(-1/slop) – 1 (Zamani i in., 2017).
Po optymalizacji krzywych standardowych, serie rozcieńczeń umieszczano w każdym przebiegu amplifikacji. Testy PCR w czasie rzeczywistym oceniano za pomocą narzędzia LinGene K Real Time PCR (Bioer, Hangzhou, PR, Chiny). Wszystkie testy wykonywano w objętości 25 μL (Zamani i in., 2017). Aby zapewnić jakość, wszystkie eksperymenty powtórzono po raz drugi niezależnie i podano średnie.
Aby sprawdzić specyficzność PCR i oczekiwaną wielkość produktu, startery zastosowano w konwencjonalnym PCR, a amplikony przepuszczono na żelu agarozowym. Ponadto, specyficzność dodatnio amplifikowanych fragmentów została potwierdzona przez sekwencjonowanie. Produkt PCR został wysłany do sekwencjonowania do południowokoreańskiej firmy Macrogen Corporation. Wyniki sekwencjonowania analizowano przy użyciu oprogramowania Chromas 2.6. Następnie wszystkie sekwencje poddano blastowaniu w bazie danych NCBI (https://blast.ncbi.nlm.nih.gov/Blast.cgi). We wszystkich sekwencjonowanych izolatach procent podobieństwa do pokrewnych genów (gen 16s rRNA i gen bft) obecnych w bazie NCBI był większy niż 95%.
Analiza statystyczna
Wyniki porównywano przy użyciu testów dokładnego Fishera, Chi kwadrat i Manna-Whitneya. P < 0,05 uznano za istotne statystycznie. Dla B. fragilis i ETBF obliczono również wartości średnie ± błąd średni (SEM). Dane analizowano przy użyciu oprogramowania statystycznego SPSS 13.0.
W tym badaniu do oceny ilorazów szans (OR) i 95% przedziałów ufności zastosowano warunkową regresję logistyczną. W tym projekcie iloraz szans jest spójnym estymatorem wskaźnika zachorowalności na CRC u osób narażonych na ETBF w porównaniu z osobami nie narażonymi.
Wyniki
W tym badaniu pobrano 68 próbek od pacjentów z CRC (36 mężczyzn i 32 kobiety; średni wiek: 55 lat; zakres: 35-78) i 52 próbki od zdrowych osób z grupy kontrolnej (HC) (30 mężczyzn i 22 kobiety; średni wiek: 56 lat; zakres: 42-78). Wszyscy pacjenci byli diagnozowani na podstawie badań kolonoskopowych wykonywanych w momencie pobierania próbek. Wszyscy pacjenci zdiagnozowani w czasie kolonoskopii dali łącznie 26 pacjentów z inwazyjnym CRC, 18 pacjentów ze zmianami ząbkowanymi, 24 pacjentów z gruczolakiem, 14 pacjentów z LGD i 10 pacjentów z HGD według aktualnej klasyfikacji (Rycina 1). Biopsje te pobrano z prawej strony (wstępująca), lewej strony (zstępująca) i z obu stron odpowiednio u 22, 32 i 14 pacjentów (Tabela 1).
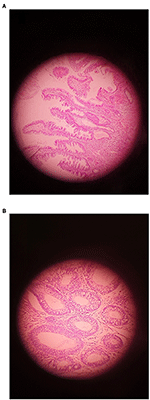
Rysunek 1. An example of Adenoma showing (A) LGD and (B) HGD (Original magnification ×400).
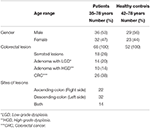
Table 1. Charakterystyka pacjentów i HC.
Wyniki hodowli B. fragilis były pozytywne dla 31(51%) i 25 (48%) próbek odpowiednio pacjentów i zdrowych kontroli (Tabela 2) (P = 0,7).

Tabela 2. Dane dotyczące hodowli Bacteroides fragilis.
Zgodnie z krzywą standardową, rozcieńczenia DNA ETBF (kontrola pozytywna) o numerach 101, 102, 103, 104, 105 i 106 dostarczyły wartości Ct odpowiednio 15,08 ± 0,1, 18,04 ± 0,2, 21,42 ± 0,2, 25,02 ± 0,2, 28,02 ± 0,4 i 31,96 ± 0,4. Skuteczność real-time PCR wynosiła od 98 do 100%.
Pozytywne próbki dla genu 16S rRNA i genu bft występowały u 63 i 47% pacjentów. Natomiast wyniki dodatnie wykazano odpowiednio w 81 i 3,8% próbek HC (Tabela 3). Różnica pomiędzy pozytywnością genu bft u pacjentów i HC była istotna statystycznie (P = 0,00).
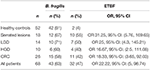
Tabela 3. Liczba próbek pozytywnych dla genu 16S rRNA i genów bft w grupach kliniczno-patologicznych i HC.
W tabeli 3 przedstawiono również liczbę próbek pozytywnych dla genów bft w CRC i HC w obrębie grup kliniczno-patologicznych. Najwyższy OR stwierdzono w grupie zmian ząbkowanych, a następnie w grupie zmian gruczolakowatych z LGD. Również OR dla wszystkich chorych (OR 22,22, 95% CI: 5, 98,74) opisywał związek ETBF z występowaniem zmian chorobowych.
Wyniki analizy ilościowej metodą real-time PCR dla liczby kopii genu 16S rRNA dla B. fragilis i genu bft dla ETBF w przeliczeniu na ng DNA przedstawiono w tabeli 4. Różnica pomiędzy liczbą kopii genu 16S rRNA u chorych i HC nie była istotna statystycznie (P ≥ 0,05). Liczba kopii genu bft była większa w próbkach pacjentów niż w próbkach zdrowych osób z grupy kontrolnej (P = 0,00). Ponadto, liczba kopii genu bft była większa w próbkach ETBF pozytywnych w grupie zmian prekursorowych w porównaniu do tych z CRC; różnica ta nie była jednak istotna statystycznie. Wyniki sekwencjonowania potwierdziły obecność genów bft i 16S rRNA (karta danych 1).
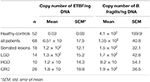
Tabela 4. Analiza ilościowa genu 16S rRNA i genów bft w grupach kliniczno-patologicznych i HC.
Wyniki badań tych próbek wskazywały ponadto, że najbardziej rozpowszechnionym podtypem genu bft był bft1, a następnie bft2. Spośród 32 izolatów posiadających gen bft, 18 (56,2%) izolatów określono jako bft-1, a 14 (43,7%) jako bft-2. Ponadto, gen bft wykryto w 2 próbkach HC i wszystkie one zostały zaklasyfikowane jako bft-1. W żadnej próbce DNA nie stwierdzono podtypu bft-3.
Dyskusja
Istnieją coraz liczniejsze dowody na wpływ dysbiozy mikrobiologicznej w jelitach, inicjację i rozwój raka jelita grubego (Sears i Garrett, 2014; Gagniere i wsp., 2016). Chociaż odnotowano niższą zachorowalność na CRC w Iranie w porównaniu z innymi krajami, przewidywano, że jej wskaźnik wzrośnie w przyszłości (Hosseini i in., 2004; Malekzadeh i in., 2009). We wcześniejszych badaniach donoszono również, że ETBF może odgrywać rolę w biegunce i IBD (Myers i wsp., 1987; Prindiville i wsp., 2000; Basset i wsp., 2004; Merino i wsp., 2011; Purcell i wsp., 2017; Zamani i wsp, 2017).
Niektóre badania sugerują, że pewne gatunki bakterii (np. ETBF) mogą działać jako bakterie patogenne, które wyjaśniają rozwój dysbiozy w społeczności mikrobiologicznej jelita i wyzwalają CRC (Hajishengallis i wsp., 2012; Hajishengallis i Lamont, 2016). Nowotworzenie jelita grubego było indukowane przez odpowiedzi immunologiczne i aktywację cytokin prozapalnych w wyniku działania BFT (Wu i in., 2004, 2009).
Wyniki tego badania wskazywały, że ETBF był istotnie związany ze zmianami ząbkowanymi, a następnie LGD. Wyższy iloraz szans w tych zmianach wskazywał również, że ekspozycja na ETBF jest czynnikiem ryzyka dla stanów nowotworowych, a zwłaszcza przedrakowych. Potwierdza to hipotezę, że szczepy produkujące BFT mogą odgrywać istotną rolę w wyzwalaniu stanu zapalnego i odpowiedzi immunologicznej u osób podatnych genetycznie, co może prowadzić do rozwoju CRC. Pierwsze badanie wykazujące zwiększoną częstość występowania ETBF w stolcu pacjentów z rakiem jelita grubego (38%) w porównaniu z grupą kontrolną (12%) przeprowadzili Ulger Toprak i wsp. (2006). Ponadto, niektóre wcześniejsze doniesienia wykazały asocjację pomiędzy genem bft a CRC, szczególnie w późnym stadium CRC (Dejea i wsp., 2014; Boleij i wsp., 2015; Viljoen i wsp., 2015). Badanie przeprowadzone przez Purcell i wsp. wykazało istotne asocjacje ETBF z gruczolakami cewkowymi, zmianami ząbkowanymi oraz dysplazją niskiego stopnia, co było podobne do wyników niniejszego badania (Purcell i wsp., 2017).
W niniejszym badaniu zmiany prekursorowe, w tym te z dysplazją niskiego stopnia, wykazywały tendencję wzrostową w ilości genu bft w porównaniu z tymi z CRC; różnica ta nie była jednak istotna statystycznie. Co więcej, autorzy wcześniej donosili, że markery ETBF obserwowano w okrężnicy i końcowym jelicie krętym pacjentów z wrzodziejącym zapaleniem jelita grubego, którzy są predysponowani do CRC (Zamani i wsp., 2017; Rashidan i wsp., 2018). Podobnie, w poprzednim badaniu wykryto jedynie podtyp bft1 tego genu (Zamani i wsp., 2017). Chociaż gen bft1 był najczęściej występującym podtypem, w niniejszym badaniu wykryto również gen bft2.
W niniejszym badaniu ETBF wykryto w zmianach chorobowych pacjentów z CRC, a podobne wyniki zostały również wcześniej przedstawione przez innych badaczy, którzy badali ETBF w próbkach błony śluzowej jelita grubego (Boleij i in., 2015; Viljoen i in., 2015). Ostatnie badania nad rolą mikrobiomu jelitowego wykazały, że dysbioza w społeczności mikrobiomu występuje w regionach nienowotworowych i nowotworowych u pacjentów z CRC (Dejea i wsp., 2014; Flemer i wsp., 2017; Purcell i wsp., 2017). W badaniach tych wykazano, że niektóre z bakterii, w tym Fusobacterium nucleatum, ETBF, Escherichia coli, Streptococcus gallolyticus i Enterococcus faecalis oraz bakterie produkujące maślan mogą odgrywać ważną rolę w rozwoju CRC (Dejea i in., 2014; Flemer et al., 2017; Park et al., 2018).
Wyniki Real-time PCR do wykrywania B. fragilis wykazały, że większy odsetek pacjentów i HC zawierał B. fragilis w porównaniu do metody hodowlanej. Złotym standardem w wykrywaniu bakterii jest metoda hodowlana, ale wymaga ona dużej liczby żywych komórek, a szczególnie w przypadku hodowli bakterii beztlenowych mogą wystąpić pewne ograniczenia. Być może te ograniczenia wpływają na różnice pomiędzy wynikami.
Różnice w hodowli B. fragilis i wynikach Real-time PCR pomiędzy kontrolami i próbkami CRC nie są znaczące. Dane te sugerują, że prawdopodobnie szczepy, które są nosicielami genu bft, a nie B. fragilis same w sobie, mogą przyczyniać się do CRC w tym badaniu. Wykazano, że B. fragilis jest wybitnym komensalem człowieka, więc bakteria ta może być izolowana również od zdrowych osób kontrolnych, takich jak pacjenci. Jednak u pacjentów ze zmianami nowotworowymi i przedrakowymi niektóre ze szczepów zawierających geny bft uległy zwiększeniu, a ta dysbioza prawdopodobnie może wywoływać stan zapalny. Dodatkowo niektóre badania wykazały, że ludzki komensal B. fragilis zapobiegał rozwojowi zapalenia jelita grubego i może stanowić skuteczną strategię terapeutyczną dla CRC, podczas gdy różne badania sugerują, że enterotoksyczne szczepy tej bakterii są związane z nowotworami jelit z powodu produkcji enterotoksyny (Sears i in., 1995, 2014; Mazmanian i in., 2008; Lee i in., 2018).
W tym badaniu istniały pewne ograniczenia. Zastosowano różne metody diagnozowania genu bft, który został wyodrębniony bezpośrednio z tkanek nowotworowych w okrężnicy pacjentów. Dlatego też, przeprowadzenie dużego populacyjnego badania kohortowego jest wysoce zalecane. Ponadto konieczne są dalsze badania w celu udowodnienia ewentualnej korelacji między obecnością genu bft a zmianami ząbkowanymi, LGD i CRC.
Wnioski
Wyniki tego badania sugerują, że ETBF może być obecny w biopsjach błony śluzowej pacjentów ze stanami przedrakowymi, takimi jak zmiany ząbkowane i LGD, oprócz pacjentów z CRC. Stwierdzono istotny związek między obecnością ETBF w tkankach objętych procesem chorobowym a liczbą tych bakterii w próbkach pobranych od pacjentów, zwłaszcza w przypadku zmian przedrakowych: gruczolaków z dysplazją małego stopnia i zmian ząbkowanych. W rzeczywistości ETBF jest częściej wykrywana we wczesnych zmianach, ale dalsze badania z większą liczbą próbek wydają się być pomocne w precyzyjnym określeniu.
Należy również przeprowadzić dodatkowe badania w celu ustalenia, czy wiek, płeć, dieta i inne czynniki środowiskowe wpływają na rozpoznanie ETBF u ludzi w czasie.
Wreszcie, ETBF może być markerem rokowania w CRC, szczególnie w zmianach przedrakowych, i może być wykorzystana w badaniach przesiewowych tych zaburzeń.
Oświadczenie o dostępności danych
Surowe dane potwierdzające wnioski zawarte w tym manuskrypcie zostaną udostępnione przez autorów, bez zbędnych zastrzeżeń, każdemu wykwalifikowanemu badaczowi.
Oświadczenie o etyce
Badania z udziałem ludzi zostały przejrzane i zatwierdzone przez Komitet Etyczny Uniwersytetu Medycznego w Teheranie. Pacjenci/uczestnicy wyrazili pisemną świadomą zgodę na udział w tym badaniu.
Wkład autorów
SZ jest pierwszym autorem, który przeprowadził wszystkie eksperymenty laboratoryjne, zebrał i przeanalizował dane oraz sporządził manuskrypt. RT jest gastroenterologiem, który wykonał kolonoskopię i dostarczył próbki ze wszystkich przypadków. LS uczestniczył w projektowaniu i koordynacji badania oraz doradzał we wszystkich jego częściach. AS i SJ uczestniczyli w zbieraniu próbek i wykonywaniu badań. MF nadzorował wszystkie części badania. Wszyscy autorzy przeczytali i zatwierdzili manuskrypt.
Funding
Ta praca była wspierana przez Tehran University of Medical Sciences (Grant No: 32467).
Konflikt interesów
Autorzy deklarują, że badania były prowadzone przy braku jakichkolwiek komercyjnych lub finansowych relacji, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Podziękowania
Autorzy chcieliby podziękować personelowi szpitala Imam Khomeini za życzliwe wsparcie w gromadzeniu próbek.
Materiały uzupełniające
Materiały uzupełniające do tego artykułu można znaleźć online pod adresem: https://www.frontiersin.org/articles/10.3389/fcimb.2019.00449/full#supplementary-material
Data Sheet 1. Wyniki sekwencjonowania genów bft i 16S rRNA w jednym izolacie.
Basset, C., Holton, J., Bazeos, A., Vaira, D., and Bloom, S. (2004). Czy gatunki Helicobacter i enterotoksyczne Bacteroides fragilis są zaangażowane w nieżyt jelit? Dig. Dis. Sci. 49, 1425-1432. doi: 10.1023/B:DDAS.0000042241.13489.88
CrossRef Full Text | Google Scholar
Boleij, A., Hechenbleikner, E. M., Goodwin, A. C., Badani, R., Stein, E. M., Lazarev, M. G., et al. (2015). The Bacteroides fragilis toxin gene is prevalent in the colon mucosa of colorectal cancer patients. Clin. Infect. Dis. 60, 208-215. doi: 10.1093/cid/ciu787
PubMed Abstract | Cross CrossRef Full Text | Google Scholar
Boyle, P., and Langman, J. (2000). ABC raka jelita grubego: epidemiologia. BMJ 321, 805-808. doi: 10.1136/bmj.321.7264.805
PubMed Abstract | CrossRef Full Text | Google Scholar
Dejea, C. M., Wick, E. C., Hechenbleikner, E. M., White, J. R., Mark Welch, J. L., Rossetti, B. J., et al. (2014). Microbiota organization is a distinct feature of proximal colorectal cancers. Proc. Natl. Acad. Sci. U.S.A. 111, 18321-18326. doi: 10.1073/pnas.1406199111
PubMed Abstract | CrossRef Full Text | Google Scholar
Ferlay, J., Soerjomataram, I., Dikshit, R., Eser, S., Mathers, C., Rebelo, M., et al. (2015). Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int. J. Cancer 136, E359-E386. doi: 10.1002/ijc.29210
PubMed Abstract | CrossRef Full Text | Google Scholar
Flemer, B., Lynch, D. B., Brown, J. M., Jeffery, I. B., Ryan, F. J., Claesson, M. J., et al. (2017). Tumour-associated and non-tumour-associated microbiota in colorectal cancer. Gut 66, 633-643. doi: 10.1136/gutjnl-2015-309595
PubMed Abstract | CrossRef Full Text | Google Scholar
Gagniere, J., Raisch, J., Veziant, J., Barnich, N., Bonnet, R., Buc, E., et al. (2016). Zaburzenia równowagi mikrobioty jelitowej a rak jelita grubego. World J. Gastroenterol. 22, 501-518. doi: 10.3748/wjg.v22.i2.501
PubMed Abstract | CrossRef Full Text | Google Scholar
Hajishengallis, G., Darveau, R. P., and Curtis, M. A. (2012). The keystone-pathogen hypothesis. Nat. Rev. Microbiol. 10, 717-725. doi: 10.1038/nrmicro2873
PubMed Abstract | CrossRef Full Text | Google Scholar
Hajishengallis, G., and Lamont, R. J. (2016). Dancing with the stars: how choreographed bacterial interactions dictate nososymbiocity and give rise to keystone pathogens, accessory pathogens, and pathobionts. Trends Microbiol. 24, 477-489. doi: 10.1016/j.tim.2016.02.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Hosseini, S. V., Izadpanah, A., and Yarmohammadi, H. (2004). Epidemiological changes in colorectal cancer in Shiraz, Iran: 1980-2000. ANZ J. Surg. 74, 547-549. doi: 10.1111/j.1445-2197.2004.03064.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Johnson, C. M., Wei, C., Ensor, J. E., Smolenski, D. J., Amos, C. I., Levin, B., et al. (2013). Meta-analizy czynników ryzyka raka jelita grubego. Cancer Causes Control. 24:120722. doi: 10.1007/s10552-013-0201-5
PubMed Abstract | CrossRef Full Text | Google Scholar
Kolahdoozan, S., Sadjadi, A., Radmard, A. R., and Khademi, H. (2010). Five common cancers in Iran. Arch. Iran Med. 13, 143-146.
PubMed Abstract | Google Scholar
Lee, Y. K., Mehrabian, P., Boyajian, S., Wu, W. L., Selicha, J., Vonderfecht, S., et al. (2018). The protective role of bacteroides fragilis in a murine model of colitis-associated colorectal cancer. mSphere. 3:e00587-e00518. doi: 10.1128/mSphere.00587-18
PubMed Abstract | CrossRef Full Text | Google Scholar
Malekzadeh, R., Bishehsari, F., Mahdavinia, M., and Ansari, R. (2009). Epidemiology and molecular genetics of colorectal cancer in iran: a review. Arch. Iran Med. 12:161-169.
PubMed Abstract | Google Scholar
Mazmanian, S. K., Round, J. L., and Kasper, D. L. (2008). A microbial symbiosis factor prevents intestinal inflammatory disease. Nature. 453, 620-625. doi: 10.1038/nature07008
PubMed Abstract | CrossRef Full Text | Google Scholar
Merino, V. R., Nakano, V., Liu, C., Song, Y., Finegold, S. M., and Avila-Campos, M. J. (2011). Quantitative detection of enterotoxigenic Bacteroides fragilis subtypes isolated from children with and without diarrhea. J. Clin. Microbiol. 49, 416-418. doi: 10.1128/JCM.01556-10
PubMed Abstract | CrossRef Full Text | Google Scholar
Moghimi-Dehkordi, B., Safaee, A., and Zali, M. (2008). Prognostic factors in 1,138 Iranian colorectal cancer patients. Int. J. Colorect. Dis. 23, 683-688. doi: 10.1007/s00384-008-0463-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Myers, L. L., Shoop, D. S., Stackhouse, L. L., Newman, F. S., Flaherty, R. J., Letson, G. W., et al. (1987). Isolation of enterotoxigenic Bacteroides fragilis from humans with diarrhoea. J. Clin. Microbiol. 25, 2230-2233.
Google Scholar
Park, C. H., Eun, C. S., and Han, D. S. (2018). Mikrobiota jelitowa, przewlekły stan zapalny i rak jelita grubego. Intest. Res. 16:338. doi: 10.5217/ir.2018.16.3.338
PubMed Abstract | CrossRef Full Text | Google Scholar
Prindiville, T., Sheikh, R., Cohen, S., Tang, Y., Cantrell, M., and Silva, J. (2000). Bacteroides fragilis enterotoxin gene sequences in patients with in?amatory bowel disease. Emerg. Infect. Dis. 6, 171-174. doi: 10.3201/eid0602.000210
CrossRef Full Text | Google Scholar
Purcell, R. V., Pearson, J., Aitchison, A., Dixon, L., Frizelle, F. A., and Keenan, J. I. (2017). Colonization with enterotoxigenic Bacteroides fragilis is associated with early-stage colorectal neoplasia. PLoS ONE 12:e0171602. doi: 10.1371/journal.pone.0171602
PubMed Abstract | CrossRef Full Text | Google Scholar
Rafiemanesh, H., Pakzad, R., Abedi, M., Kor, Y., Moludi, J., Towhidi, F., et al. (2016). Colorectal cancer in Iran: epidemiology and morphology trends. EXCLI J. 15, 738-744. doi: 10.17179/2Fexcli2016-346
PubMed Abstract | CrossRef Full Text | Google Scholar
Rashidan, M., Azimirad, M., Alebouyeh, M., Ghobakhlou, M., Aghdaei, H. A., and Zali, M. R. (2018). Detection of B. fragilis group and diversity of bft enterotoxin and antibiotic resistance markers cepA, cfiA and nim among intestinal Bacteroides fragilis strains in patients with inflammatory bowel disease. Anaerobe 50, 93-100. doi: 10.1016/j.anaerobe.2018.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Sears, C. L., and Garrett, W. S. (2014). Mikroby, mikrobiota i rak jelita grubego. Cell Host Microbe 15, 317-328. doi: 10.1016/j.chom.2014.02.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Sears, C. L., Geis, A. L., and Housseau, F. (2014). Bacteroides fragilis subverts mucosal biology: from symbiont to colon carcinogenesis. J. Clin. Invest. 124, 4166-4172. doi: 10.1172/JCI72334
PubMed Abstract | CrossRef Full Text | Google Scholar
Sears, C. L., Myers, L. L., Lozenby, A., and Van Tassel, R. L. (1995). Enterotoksyczne Bacteroides fragilis. Clin Infect Dis. 20(suppl):142-148. doi: 10.1093/clinids/20.Supplement_2.S142
CrossRef Full Text | Google Scholar
Siegel, R., DeSantis, C., and Jemal, A. (2014). Statystyki dotyczące raka jelita grubego, 2014. Cancer J. Clinic. 64, 104-117. doi: 10.3322/caac.21220
PubMed Abstract | CrossRef Full Text | Google Scholar
Świderska, M., Choromańska, B., Dąbrowska, E., Konarzewska-Duchnowska, E., Choromańska, K., Szczurko, G., et al. (2014). Diagnostyka raka jelita grubego. Contempor Oncol. 18, 1-6. doi: 10.5114/wo.2013.39995
PubMed Abstract | CrossRef Full Text | Google Scholar
Ulger Toprak, N., Yagci, A., Gulluoglu, B. M., Akin, M. L., Demirkalem, P., Celenk, T., et al. (2006). A possible role of Bacteroides fragilis enterotoxin in the etiology of colorectal cancer. Clin. Microbiol. Infect. 12, 782-786. doi: 10.1111/j.1469-0691.2006.01494.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Viljoen, K. S., Dakshinamurthy, A., Goldberg, P., and Blackburn, J. M. (2015). Quantitative profiling of colorectal cancerassociated bacteria reveals associations between fusobacterium spp., enterotoxigenic Bacteroides fragilis (ETBF) and clinicopathological features of colorectal cancer. PLoS ONE 10:e0119462. doi: 10.1371/journal.pone.0119462
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, S., Lim, K. C., Huang, J., Saidi, R. F., and Sears, C. L. (1998). Bacteroides fragilis enterotoxin cleaves the zonula adherens protein, E-cadherin. Proc. Natl. Acad. Sci. U.S.A. 95, 14979-14984. doi: 10.1073/pnas.95.25.14979
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, S., Morin, P. J., Mauyo, D. J. I. K., and Sears, C. (2003). Bacteroides fragilis enterotoxin induces c-myc expression and cellular proliferation. Gastroenterology 124, 392-400. doi: 10.1053/gast.2003.50047
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, S., Powell, J., Mathioudakis, N., Kane, S., Fernandez, E., and Sears, C. L. (2004). Bacteroides fragilis enterotoxin induces intestinal epithelial cell secretion of interleukin-8 through mitogen-activated protein kinases and a tyrosine kinase-regulated nuclear factor-kappaB pathway. Infect. Immun. 72, 5832-5839. doi: 10.1128/IAI.72.10.5832-5839.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, S., Rhee, K. J., Albesiano, E., Rabizadeh, S., Wu, X., Yen, H. R., et al. (2009). A human colonic commensal promotes colon tumorigenesis via activation of T helper type 17 T cells responses. Nat. Med. 15, 1016-1022. doi: 10.1038/nm.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Zamani, S., Shariati, S. H., Zali, M. R., Aghdaei, H. A., Asiabar, A. S., Bokaie, S., et al. (2017). Detection of enterotoxigenic Bacteroides fragilis in patients with ulcerative colitis. Gut Pathogens 9:53. doi: 10.1186/s13099-017-0202-0
PubMed Abstract | CrossRef Full Text | Google Scholar
.